分子シャペロン効果による目的タンパク質の可溶化収率の向上
製品説明
組換えバキュロウイルスを利用したタンパク質発現系のメリットは、宿主昆虫細胞内での(1)翻訳後修飾(リン酸化、ミリストイル化、パルミトイル化など)、(2)哺乳動物細胞に近い糖鎖修飾(N-グリコシレーション)、(3)分子量の大きいタンパク質発現が可能、(4)発現タンパク質が大量でも可溶性画分として比較的回収し易い、(5)発現系の夾雑タンパク質含量やタンパク質分解酵素量が少なく精製が比較的容易、など大腸菌発現系、酵母発現系にはない多くのメリットがあり、主に哺乳動物由来タンパク質の大量発現系として構造解析研究や機能解析研究に応用されている。しかし一方で細胞内での ”over expression”によりミスフォールドした目的タンパク質がインクルージョンボディ(封入体)を形成し凝集したり、酵素分解を受けてしまう事例がしばしばある。このような原因の多くは、細胞内の分子シャペロンの枯渇が考えられている。そのため、分子シャペロンを供給するベクターを共導入する方法などがこれまで試みられてきたが、導入した細胞によってシャペロン発現量にばらつきがあるため目的タンパク質の可溶性や収量が安定しないという問題を抱えていた。(図1)

図1
ProFoldベクターは、クロンテック社の核多角体病バキュロウイルス(AcNPV)由来BacPAK6 Viral DNA(Bsu36Ⅰdigest) (Kitts A.P. and Possee R.D., Biotechniques, 14 : 810-817, 1993.)を基礎に上記の問題を解決するために改良したベクターである。本ベクターは、ウイルス感染末期に大量発現する核多角体主要構成物質ポリヘドリンをコードするウイルスゲノム部位を制限酵素Bsu36 Iで切断処理し線状化してあり、さらに主要なヒト由来(一部酵母由来)分子シャペロンをコードする遺伝子が組み込まれている。(図2)
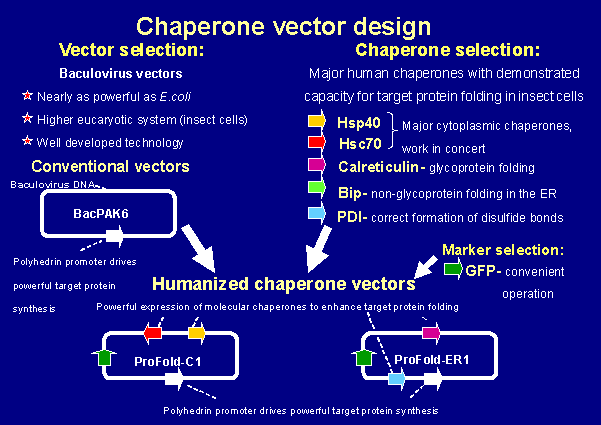
図2
目的遺伝子をクローニングしたトランスファーベクターとProFoldベクターを昆虫細胞株(Sf9、Sf21など)にコトランスフェクションすることで、ポリヘドリン部位で相同組換えを誘発し、目的の遺伝子が導入された組換えバキュロウイルス粒子を高効率で産生させることができる。ProFoldベクターシリーズは、発現させたい目的タンパク質の局在性(細胞質タンパク質、膜タンパク質、分泌タンパク質)やER(小胞体)移送性などにより最適な分子シャペロンの組み合わせが選択できる。(表1、図3)

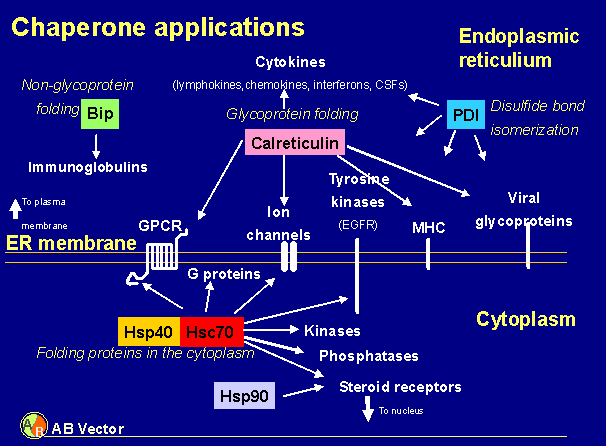
図3
ProFold-C1、ProFold-C2は細胞質内の主要な分子シャペロンであるヒト由来Hsc70/Hsp40を供給するベクターであり、目的タンパク質が細胞質に局在する場合に最適である。ProFold-ER1は、ER内腔での糖タンパク質のフォールディングを促進するヒト由来calreticulinおよびジスルフィド結合の組換えを触媒するヒト由来protein disulfide isomerase(PDI)を供給するベクターであるため、膜タンパク質、分泌タンパク質、あるいはシステインリッチなタンパク質などER移送性の糖タンパク質の発現に最適である。また、ProGreen、ProFold-C1、-C2、-ER1には、Aequorea victoria由来の緑色蛍光タンパク質であるGFPをマーカーとして発現するので、ウイルス増殖モニタリング、培養条件の最適化、力価既知のコントロールウイルス(Green Control)を対照とした”terminal green dilution”によるウイルスストックの力価測定を簡便に行うことができる。(図4)
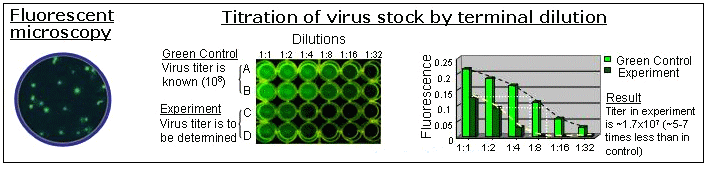
図4
GFPマーカーは、ウイルス増殖のモニタリングと培養条件の最適化に利用できる。
ウイルス力価は、緑色の細胞を蛍光顕微鏡でカウントするか、または力価既知のGreen Control Baculovirus(製品コード C14)を利用した"terminal green dilution"法により測定することができる。
図4右側に示した通り、力価既知のGreen Controlウイルスストック(A,B)と比較することにより、新規に生成したウイルスストック(C,D)の力価を決定することができる。

図1
ProFoldベクターは、クロンテック社の核多角体病バキュロウイルス(AcNPV)由来BacPAK6 Viral DNA(Bsu36Ⅰdigest) (Kitts A.P. and Possee R.D., Biotechniques, 14 : 810-817, 1993.)を基礎に上記の問題を解決するために改良したベクターである。本ベクターは、ウイルス感染末期に大量発現する核多角体主要構成物質ポリヘドリンをコードするウイルスゲノム部位を制限酵素Bsu36 Iで切断処理し線状化してあり、さらに主要なヒト由来(一部酵母由来)分子シャペロンをコードする遺伝子が組み込まれている。(図2)

図2
目的遺伝子をクローニングしたトランスファーベクターとProFoldベクターを昆虫細胞株(Sf9、Sf21など)にコトランスフェクションすることで、ポリヘドリン部位で相同組換えを誘発し、目的の遺伝子が導入された組換えバキュロウイルス粒子を高効率で産生させることができる。ProFoldベクターシリーズは、発現させたい目的タンパク質の局在性(細胞質タンパク質、膜タンパク質、分泌タンパク質)やER(小胞体)移送性などにより最適な分子シャペロンの組み合わせが選択できる。(表1、図3)
| マーカーあるいは分子シャペロンの種類 | GFP | β-gal | Hsc70 | Hsp40 | Calreticulin | PDI | |
| 役割 | 増殖モニタリング、力価測定に利用 | 組み換え体のプラークアッセイに利用 | 細胞質内シャペロン | 細胞質内シャペロン | ER内腔での糖タンパク質のフォールディング | ERでのジスルフィド結合の組換え | |
| 製品名 | 製品 コード |
Protein Expression Level | |||||
| ProGreen | A1 | +++ | +++++ | ||||
| ProFold-C1 | A2 | +++ | +++++ | +++ | ++ | ||
| ProFold-C2 | A3 | +++ | ++++ | +++ | +++++ | ||
| ProFold-ER1 | A4 | +++ | +++++ | +++ | ++++ | ||
| ProFold-PDI | A7 | +++++ | ++++ | ||||

図3
ProFold-C1、ProFold-C2は細胞質内の主要な分子シャペロンであるヒト由来Hsc70/Hsp40を供給するベクターであり、目的タンパク質が細胞質に局在する場合に最適である。ProFold-ER1は、ER内腔での糖タンパク質のフォールディングを促進するヒト由来calreticulinおよびジスルフィド結合の組換えを触媒するヒト由来protein disulfide isomerase(PDI)を供給するベクターであるため、膜タンパク質、分泌タンパク質、あるいはシステインリッチなタンパク質などER移送性の糖タンパク質の発現に最適である。また、ProGreen、ProFold-C1、-C2、-ER1には、Aequorea victoria由来の緑色蛍光タンパク質であるGFPをマーカーとして発現するので、ウイルス増殖モニタリング、培養条件の最適化、力価既知のコントロールウイルス(Green Control)を対照とした”terminal green dilution”によるウイルスストックの力価測定を簡便に行うことができる。(図4)

図4
GFPマーカーは、ウイルス増殖のモニタリングと培養条件の最適化に利用できる。
ウイルス力価は、緑色の細胞を蛍光顕微鏡でカウントするか、または力価既知のGreen Control Baculovirus(製品コード C14)を利用した"terminal green dilution"法により測定することができる。
図4右側に示した通り、力価既知のGreen Controlウイルスストック(A,B)と比較することにより、新規に生成したウイルスストック(C,D)の力価を決定することができる。
保存
4℃
特長
- 分子シャペロンにより可溶性と収量を大幅に向上
- 目的タンパク質の局在性によりベクター選択が可能
- GFPによる力価測定、増殖モニタリングが可能
- 一般的なトランスファーベクターの利用が可能
使用上の注意
本製品には、実験プロトコールは添付されておりませんので、あらかじめご了承ください。
遺伝子相同組換え法による一般的な実験プロトコールがご入用の場合は、BacPAK Baculovirus Expression Systemの実験プロトコールをご参照ください。
遺伝子相同組換え法による一般的な実験プロトコールがご入用の場合は、BacPAK Baculovirus Expression Systemの実験プロトコールをご参照ください。
ProFoldはAB Vector社のトレードマークです。
Application
この製品を見た人は、
こんな製品も見ています
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。

