- 第十八改正日本薬局方のマイコプラズマ否定試験に従い検出感度・特異性・頑健性について確認済み
- 核酸抽出キット(別売)*はすべてのロットでマイコプラズマDNAのコンタミネーションを検査済み
*NucleoSpin Mycoplasma DNA(製品コード 740860.50) - リアルタイムPCR法により1日で結果判定が完了
またはタカラバイオ(株)テクニカルサポートライン(TEL:077-565-6999)までお問い合わせください。
https://www.takara-bio.co.jp/research/support/tsl/
WEB会員ログインが必要です
製品説明
マイコプラズマは微小な細菌で、動物細胞等に感染した場合、細胞の増殖や特性に有害な影響を与えることが知られています。一方でマイコプラズマは、非常に微小であるため、再生医療等製品などの製造工程で使用する不純物除去フィルターでは除去が難しく、マイコプラズマ感染が大きな問題となっています。このような理由から、細胞を主成分とする再生医療等製品などではマイコプラズマ汚染を否定することが強く求められています。
従来、培地を用いた培養法、指標細胞を用いたDNA染色法によるマイコプラズマ否定試験等がなされてきましたが、培養法では28日間、DNA染色法では4~7日間と時間を要することが課題でした。
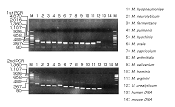
本製品はリアルタイムPCR法を用いて、日本薬局方などの公定法で規定された7種のマイコプラズマ遺伝子を約1時間で検出します。
また、第十八改正日本薬局方 参考情報の「バイオテクノロジー応用医薬品/生物起源由来医薬品の製造に用いる細胞基材に対するマイコプラズマ否定試験C. 核酸増幅法(NAT)」に示されているバリデーションを実施した上で、「C.核酸増幅法(Nucleic acid amplification test:NAT)」として利用することが可能です。
*第十八改正日本薬局方参考情報の「バイオテクノロジー応用医薬品/生物起源由来医薬品の製造に用いる細胞基材に対するマイコプラズマ否定試験C. 核酸増幅法(NAT)」に記載された方法でのバリデーション試験を実施し、下記7菌種のMycoplasma標準品すべてにつき95%陽性カットオフ値が10 cfu/ml(M. pneumoniaeについては1 ccu/ml)以下であり、日本薬局方記載のA法(培養法)の代替法とする場合の検出感度を満たすことを確認しています。
バリデーション試験の詳細は、下記URLよりダウンロードください。TaKaRa Mycoplasma qPCR Detection Kitバリデーション試験データ
- TaKaRa Mycoplasma qPCR Detection Kitでは、核酸抽出キットとしてNucleoSpin Mycoplasma DNA(製品コード 740860.50)を推奨しています。(2024年6月~)
- バリデーション試験データ(2017年取得)では、核酸抽出キットとしてNucleoSpin Virus(製品コード 740983.10/.50/.250)を、リアルタイムPCR機種にはThermal Cycler Dice Real Time System III /II(製品コード TP970/TP900:終売)を使用しています。
- NucleoSpin Mycoplasma DNAとNucleoSpin Virusの比較資料をご希望の方は、テクニカルサポートラインにお問い合わせください 。(https://www.takara-bio.co.jp/research/support/tsl/)
本製品は、東京医科歯科大学(現東京科学大学) 再生医療研究センターの清水則夫先生が、国立研究開発法人 科学技術振興機構(JST)および国立研究開発法人 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラムの公的支援の下で得た研究成果に基づくものであり、清水先生とタカラバイオ(株)との共同研究によって開発されました。
一般社団法人 再生医療イノベーションフォーラム作成の「試験検査法/機器のFIRM事例集(第1集)
「再生医療等安全性確保法」の下に提供される細胞等の品質管理」に本キットが掲載されています。
内容
| ●1.Probe qPCR Mix | 960 μl×3本 |
| ○2.Primer/Probe Mix (Myco)*1 | 384 μl |
| ○3.Primer/Probe Mix (Spike-in)*1 | 192 μl |
| ○4.H2O | 1 ml×2本 |
| ●5.Positive Control (Myco)*2 | 300 μl |
| ●6.PC Dilution Buffer | 1 ml×2本 |
| ●7.Spike-in Control DNA | 1 ml |
*1 蛍光標識プローブ(FAM 標識)を含んでいるため、遮光に留意してください。
*2 Positive Control (Myco)を希釈し感度コントロールとして使用する場合等に使用します。
保存
キット以外に必要な試薬、器具、機器(主なもの)
【試薬】
- 核酸抽出キット
NucleoSpin Mycoplasma DNA(製品コード 740860.50)
【器具】
- 200 μl、20 μl、10 μl 各マイクロピペット
- マイクロピペット用チップ(疎水性フィルター付)
- 0.1 ml 8-strip -neo- tube & cap Set(製品コード NJ907)
【機器】
- 微量高速遠心機
- ヒートブロック
- リアルタイムPCR装置
Thermal Cycler Dice Real Time System III with PC(製品コード TP970)
Thermal Cycler Dice Real Time System II(製品コード TP900/TP960:終売)
Applied Biosystems 7500 Fast Real-Time PCR System(Thermo Fisher Scientific社)
LightCycler 480 システム(Roche Diagnostics社)
CFX96 Real-Time PCR Detection System(Bio-Rad社)
補足資料
Quick Manual ~定性解析(+/-判定)用~(PDF、946 K)
この製品を見た人は、
こんな製品も見ています
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。