アデノ随伴ウイルス(AAV)ベクターによる遺伝子導入 Q&A
全表示/全非表示
◆アデノ随伴ウイルス(AAV)、AAVベクターについて
Q1 AAVの特徴は?
A1 アデノ随伴ウイルス(Adeno Associated Virus:AAV) は、パルボウイルス科ディペンドウイルス属に属する非エンベロープウイルスです。AAVはヒトへの病原性が知られておらず、カプシド構造タンパク質により、種々の組織/細胞への感染指向性が異なることが知られています。
Q2 AAVベクターの特徴は?
A2 AAVベクターは、AAVの特徴を活かしたウイルスベクターです。In vitroはもちろん、In vivoにおいても分裂/非分裂細胞へ遺伝子導入が可能です。また、導入された遺伝子は感染細胞のゲノムに組込まれる可能性は極めて低く、非分裂細胞においては長期間の遺伝子発現が可能です。
Q3 血清型(セロタイプ)について知りたい。
A3 AAVの血清型(セロタイプ)は、カプシド構造タンパク質の種類によって分類されています。その違いにより、種々の組織/細胞への感染指向性が異なることが知られています。
タカラバイオでは血清型1、2、5、6、8、9 のアデノ随伴ウイルスベクター調製システムを発売しています。血清型2(AAV2)は古くから広く研究されてきた血清型の1つであり、宿主域が大変広いことが知られています。血液型1(AAV1)、血清型5(AAV5)、血清型6(AAV6)、血清型8(AAV8)、血清型9(AAV9)は、より高い組織指向性を持った血清型です。AAV1は筋肉、肝臓、気道、中枢神経系等、AAV5は中枢神経系、肝臓、網膜等、AAV6は心臓、筋肉、肝臓等、AAV8は肝臓、筋肉、中枢神経系等、AAV9は中枢神経系、心臓、肝臓、筋肉等への遺伝子導入効率が高いと言われています。
より詳細な情報は、こちらをご参照ください。
より詳細な情報は、こちらをご参照ください。
Q4 AAVベクターを使用する際の遺伝子組換え生物の拡散防止措置レベルが知りたい。
A4 AAVベクターは文部科学省の定める省令(「研究開発等に係る遺伝子組換え生物等の第二種使用等に当たって執るべき拡散防止措置等を定める省令」平成16 年文部科学省・環境省令第1 号)にあるP1 レベルの施設で取り扱いが可能です。ただし、挿入断片によっては拡散防止措置を上げる必要があります。ご利用の際は省令および組織内の組換えDNA 実験安全委員会の指示に従い、安全には十分ご注意ください。
Q5 AAVベクターを使用した遺伝子導入を実施している例(文献)が知りたい。
A5 AAVに関する特設サイト「アデノ随伴ウイルスAAVによる遺伝子導入 参考文献」にまとめていますのでご参照ください。
http://catalog.takara-bio.co.jp/product/basic_info.php?unitid=U100009106
http://catalog.takara-bio.co.jp/product/basic_info.php?unitid=U100009106
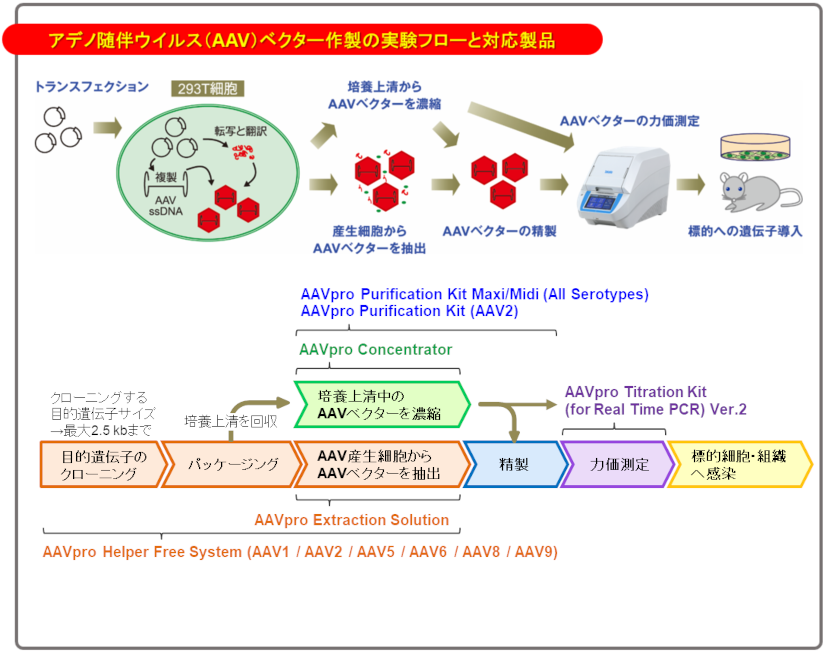
◆組換えアデノ随伴ウイルス作製システム(AAVpro Helper Free System)について
Q6 Helper Free Systemについて知りたい。
A6 一般的にAAVの複製には、アデノウイルスやヘルペスウイルスのようなヘルパーウイルスが必要ですが、Helper Free Systemではヘルパーウイルスを使用せずに、目的遺伝子を含むAAVベクターゲノムがパッケージングされたアデノ随伴ウイルスベクター(AAVベクター)を調製できます。
Q7 AAVベクターに挿入できる目的遺伝子のサイズは?推奨のサイズより大きい場合、どんな影響があるか?
A7 AAVベクターのITR間には4.5 kb程度のフラグメントが挿入可能です。各セロタイプのAAVpro Helper Free Systemに含まれるpAAV-CMV Vectorにはプロモーターなどの発現ユニットが挿入されていることから2.5 kb程度までのフラグメントが挿入可能です。
それ以上の長さのフラグメントを挿入されますと、ウイルスベクターの力価の低下や中空粒子の増加、またはウイルスベクター自体が産生されない原因となります。
それ以上の長さのフラグメントを挿入されますと、ウイルスベクターの力価の低下や中空粒子の増加、またはウイルスベクター自体が産生されない原因となります。
Q8 AAVベクターの作製に適した細胞は何か?
A8 AAVpro Helper Free Systemを用いる場合は、HEK293細胞、HEK293T細胞をご使用ください。
HEK293もしくはHEK293T細胞にはいくつかの系統が知られています。AAVpro 293T Cell Line(製品コード 632273)、もしくはHEK293T/17(ATCC CRL 11268)の使用でAAVベクター産生が安定して行えることを確認していますので、これらの細胞の使用をお勧めします。なお、弊社の検討において、一般的に使用されている細胞株ではAAVベクターの産生量が少ない場合が多いことを確認しています。
HEK293もしくはHEK293T細胞にはいくつかの系統が知られています。AAVpro 293T Cell Line(製品コード 632273)、もしくはHEK293T/17(ATCC CRL 11268)の使用でAAVベクター産生が安定して行えることを確認していますので、これらの細胞の使用をお勧めします。なお、弊社の検討において、一般的に使用されている細胞株ではAAVベクターの産生量が少ない場合が多いことを確認しています。
Q9 培養細胞に感染させたが感染が確認できない。原因として何が考えられるか?
A9 高タイターのAAVベクターが得られていない可能性が考えられます。高タイターのAAVベクターが得られない原因としては下記が考えられます。
- HEK293やHEK293T細胞にはいくつかの系統が知られています。弊社の検討では、一般的に使用されている細胞株ではAAVベクターの産生量が非常に少ない場合が多いことを確認しています。AAVpro 293T Cell Line(製品コード 632273)、もしくはHEK293T/17(ATCC CRL 11268)を使用することでAAVベクター産生が安定して行えることを確認しており、AAVベクター産生にはこれらの細胞の使用をお勧めします。
- トランスフェクション効率が低い可能性が考えられます。高タイターのAAVベクターを取得するために、高いトランスフェクション効率が不可欠となります。ユーザーマニュアル記載のトランスフェクション法でお試しください。
Q10 遺伝子導入のコントロール用ベクターは販売しているか?
A10 LacZ、ZsGreen1を発現するAAVベクタープラスミドをそれぞれ販売しております。
Q11 一般的に動物実験に必要なAAVベクター量が知りたい。
A11 セロタイプや標的組織、投与方法により異なりますが、マウスの場合1×1011~1×1012 vg /マウス程度のAAVベクター量となります。ただし、ここで挙げた投与量は、あくまで参考値です。文献等でご確認いただき、投与量を決定してください。(Vg=Vector genome;リアルタイムPCR法により測定)
Q12 他社と比較しての利点は?
A12 セロタイプ2のAAVpro Helper Free Systemに含まれるpRC2-mi342 VectorにはAAV2ベクター産生能を指標にスクリーニングしてきたmiRNAの一種であるhas-miR342が含まれます。一般的なRepおよびCapのみを発現するpRC2 Vector使用時と比較して約2倍のタイター向上効果が確認されております。
Q13 ウイルスを大量に産生するには?
A13 293T細胞へのトランスフェクションの段階からスケールアップをしていただければ対応可能です。この場合、精製済のpRC VectorとpHelper VectorをセットにしたAAVpro Packaging Plasmidシリーズの使用をお勧めします。
◆アデノ随伴ウイルスベクター精製キット(AAVpro Purification Kit Maxi/Midi (All Serotypes))について
Q14 適用できるセロタイプについて
A14 原理的には、全てのセロタイプに適用可能です。実際のデータに関しましては、精製後の各セロタイプの純度測定、精製AAVベクターの感染能評価、遺伝子導入実験例(AAVベクターを用いた鳴禽類Zebra Finch脳への遺伝子導入、AAVベクターを用いたマウス大脳皮質(視覚野)への遺伝子導入)をご参照ください。
Q15 本キットで処理できる細胞量はどのくらいか?
A15 精製操作1回につき、AAVpro Purification Kit Maxi (All Serotypes)はT225フラスコ5枚まで、AAVpro Purification Kit Midi (All Serotypes)はT225フラスコ1枚までの細胞からAAV粒子の精製が可能です。
※ 1キットは精製4回分の容量です。
※ 1キットは精製4回分の容量です。
Q16 本キットを用いた精製で気をつけるポイントは?
A16 各工程にいくつかのポイントがございます。詳細については、取扱説明書のVI.実験操作に記載の注意書きをご参照ください。
◆アデノ随伴ウイルスベクター精製キット(AAVpro Purification Kit (AAV2))について
Q17 セロタイプ2以外の精製にも使用できるか?
A17 本キットは、セロタイプ2専用です。その他のセロタイプ、もしくはセロタイプ2に関してもより簡便に精製を行いたい場合は、AAVpro Purification Kit Maxi (All Serotypes)(製品コード 6666)、またはAAVpro Purification Kit Midi (All Serotypes)(製品コード 6675)をご使用ください。
Q18 AAVベクターの精製は一般的には超遠心法で行うが、精製キットを使用するメリットは?
A18 超遠心法は一般的な精製方法ですが、熟練した技術が必要であり、精製工程に2~3日間以上を要します。
AAVpro Purification Kit (AAV2)の使用により、約4時間でAAV2粒子産生細胞からAAV2粒子を精製することができるため、どなたでも短時間で簡便にご利用いただけます。
また、本キットを使用した場合の収量についてはこちらをご参照ください。
AAVpro Purification Kit (AAV2)の使用により、約4時間でAAV2粒子産生細胞からAAV2粒子を精製することができるため、どなたでも短時間で簡便にご利用いただけます。
また、本キットを使用した場合の収量についてはこちらをご参照ください。
Q19 キットで精製できる細胞数(フラスコ数)はどのくらいか?
A19 Prepacked Column 1本につきT225フラスコ10枚までの細胞からAAV2粒子の精製が可能です。(T225フラスコ5枚分の精製を推奨します。)
Q20 動物(主にマウス)へ投与したいが、どの程度精製したらよいか?
A20 明確な基準はありませんが、SDS-PAGEに供した際にAAVベクター由来の3本のバンド(VP1、VP2、VP3)が主要バンドとして確認できるまで精製を行えば、動物への投与は可能であると思われます。AAVpro Purification Kit (AAV2)を用いて精製されたAAV2粒子は動物への投与が可能です。実際に精製したAAV2-ZsGreenをマウス脳線条体へ投与し、遺伝子導入できていることを確認しています。
AAV2ベクターを用いたマウス脳線条体への遺伝子導入
Q21 カラム流速が遅くなった場合、原因として何が考えられるか?
A21 カラムの樹脂部分に空気が含まれる場合、流速が遅くなることがあります。使用前にご確認いただき、空気が含まれている場合はピペッティングで空気除去後、樹脂を沈めてご使用ください。
また、不純物の多いサンプルを添加した場合にも流速が遅くなる場合があります。遠心、もしくは低吸着タイプの0.45 μmのフィルターでろ過することで解決することがあります。
また、不純物の多いサンプルを添加した場合にも流速が遅くなる場合があります。遠心、もしくは低吸着タイプの0.45 μmのフィルターでろ過することで解決することがあります。
◆アデノ随伴ウイルスベクターの力価測定キット(AAVpro Titration Kit (for Real Time PCR) Ver.2)について
Q22 どのセロタイプが測定できるか?
A22 本キットはAAV2のITR領域にプライマーを設計していますので、AAV2のITRを使用したAAVベクターであれば、セロタイプを問わずに測定することが可能です。
Q23 従来のタイター測定法と比べてどんな利点があるか?
A23 従来、AAVベクターゲノムを定量する際には挿入配列上に増幅領域を設定していました。そのため、AAVベクターごとにプライマーを設計する必要がありました。AAVpro Titration Kit (for Real Time PCR) Ver.2は、AAV2由来のITRをターゲットとしてベクターゲノムを定量するキットであり、ウイルス粒子内に封入されているベクターゲノムのITR領域がAAV2由来であれば、血清型に関わらず本製品を使用することができます。
Q24 AAV Titration Kit Ver.2で得られたサンプルのコピー数の換算方法は?
A24 換算方法は 以下の例を参照してください。
例)
AAVベクターの抽出:10 cmディッシュよりAAVを抽出 550 μl
DNase I処理:×10希釈
Lysis Buffer 添加:×2希釈
Easy Dilutionによる希釈:×50希釈
PCRのテンプレートとして5 μl使用
検量線より得られたコピー数:1×107 copiesの場合
もとの抽出液(550 μl)のcopy/ mlの計算方法
1×107 copies/5×50×2×10×1000=2×1012 copies/mlになります。
AAVベクターの抽出:10 cmディッシュよりAAVを抽出 550 μl
DNase I処理:×10希釈
Lysis Buffer 添加:×2希釈
Easy Dilutionによる希釈:×50希釈
PCRのテンプレートとして5 μl使用
検量線より得られたコピー数:1×107 copiesの場合
もとの抽出液(550 μl)のcopy/ mlの計算方法
1×107 copies/5×50×2×10×1000=2×1012 copies/mlになります。
◆アデノ随伴ウイルスベクターの抽出試薬(AAVpro Extraction Solution)について
Q25 どのセロタイプで使用できるか?
A25 セロタイプを問わずに使用可能です。ただし、セロタイプによっては凍結融解法と比較して抽出効率が低くなる場合があります。弊社の検討でAAV5においては凍結融解法と比較して抽出効率が低くなる場合があることを確認していますが、その場合においても夾雑物の混入はAAVpro Extraction Solutionを用いて抽出した方が明らかに少ないことを確認しています。
Q26 AAV Extraction Solution Bを添加した際、液がピンク色に変色したが?
A26 サンプルによってはAAV Extraction Solution Bを添加した際にピンク色に変色することがありますが、性能には問題ありません。
◆アデノ随伴ウイルスベクター濃縮キット(AAVpro Concentrator)について
Q27 アデノ随伴ウイルスの産生において、ウイルス産生培養細胞内に蓄積するウイルスと培養上清に存在するウイルスの比率はどの程度でしょうか?
A27 ウイルスの血清型により比率は異なります。例えば、血清型1(AAV1)や血清型6(AAV6)は、培養細胞よりも培養上清に多く存在していたという結果データがあります(参考文献1)。以下の文献をご覧いただき、参考にしてください。
- Luk H. Vandenberghe, Ru Xiao, Martin Lock, Jianping Lin, Michael Korn, and James M.
Efficient Serotype-Dependent Release of Functional Vector into the Culture Medium During Adeno-Associated Virus Manufacturing
PMC 2010 Oct; 21(10): 1251-1257. - Martin Lock, Mauricio Alvira, Luk H. Vandenberghe, Arabinda Samanta, Jaan Toelen, Zeger Debyser, and James M. Wilson
Rapid, Simple, and Versatile Manufacturing of Recombinant Adeno-Associated Viral Vectors at Scale
PMC 2010 Oct; 21(10): 1259-1271.
◆その他
Q28 AAVでTet-Systemを用いた発現誘導を行いたいが適した製品はあるか?
Q29 AAVpro CRISPR/SaCas9 Helper Free System (AAV2)を用いて実験を行う予定だが、参考文献などあるか?
A29 こちらの参考文献をご覧いただき、参考にしてください。
Q30 AAVベクターの作製は受託サービスのメニューにあるか?
A30 ウイルス発現用ベクタープラスミドの構築から組換えAAVウイルスの作製までを承っております。オプションサービスとして力価測定やAAVベクターの精製も承ります。
詳しくはこちらのウェブサイトをご覧ください。
詳しくはこちらのウェブサイトをご覧ください。
◆アデノ随伴ウイルス(AAV)ベクター作製受託サービスについて
Q31 受託作製可能なAAVベクターの血清型は?
A31 製品ラインナップのある、血清型1、2、5、6、8、9さらにタカラバイオ独自のCereAAVシリーズは製造可能です。
上記以外の血清型の場合、お客様自身でプラスミドを手配していただくことで対応可能です。
上記以外の血清型の場合、お客様自身でプラスミドを手配していただくことで対応可能です。
Q32 収量保証や希望のタイターで作製は可能か?
A32 いいえ。
AAVベクター作製量は目的遺伝子と血清型の組み合わせにより変動するため、収量保証はいたしかねます。タイターも事前予想が難しい面もございますが、精製作業終了後のAAVベクタータイターを確認いただき、オプションとして希釈あるいは濃縮を実施可能です。
AAVベクター作製量は目的遺伝子と血清型の組み合わせにより変動するため、収量保証はいたしかねます。タイターも事前予想が難しい面もございますが、精製作業終了後のAAVベクタータイターを確認いただき、オプションとして希釈あるいは濃縮を実施可能です。
Q33 配列情報から作製は可能か?
A33 可能ですがオプションになります。
目的遺伝子を挿入した発現プラスミドDNA(pAAV-GOI vector)の作製からもオプションとして承っております。
目的遺伝子を挿入した発現プラスミドDNA(pAAV-GOI vector)の作製からもオプションとして承っております。
Q34 タカラバイオでAAVベクター作製に使用できる細胞種は?
A34 HEK293T、HEK293を用意しています。目的によってはマスターセルバンク(MCB)のご利用も可能です。
別途お客様自身で手配していただくことで対応可能な細胞もございます(製造検討から実施します)。
別途お客様自身で手配していただくことで対応可能な細胞もございます(製造検討から実施します)。
Q35 ウイルスタイターの算出方法は?
A35 タカラバイオ製品のAAVpro Titration Kit (for Real Time PCR) Ver.2(製品コード 6233)を使用して算出しています。
ウイルス粒子からウイルスゲノムを粗抽出し、ITR領域を対象としたqPCRによって、ウイルスゲノムのタイターを定量化しています。オプションとして、他のタイター測定方法(TCID50など)もご提供しています。お見積りの際にお問い合わせください。
ウイルス粒子からウイルスゲノムを粗抽出し、ITR領域を対象としたqPCRによって、ウイルスゲノムのタイターを定量化しています。オプションとして、他のタイター測定方法(TCID50など)もご提供しています。お見積りの際にお問い合わせください。
Q36 品質試験のラインナップは?
A36
- 感染力価試験(TCID50法)
- ELISAによる検出
- SDS-PAGEによるキャプシドタンパク確認試験
- 完全粒子含有率確認試験(電子顕微鏡)
- 各種品質試験項目

