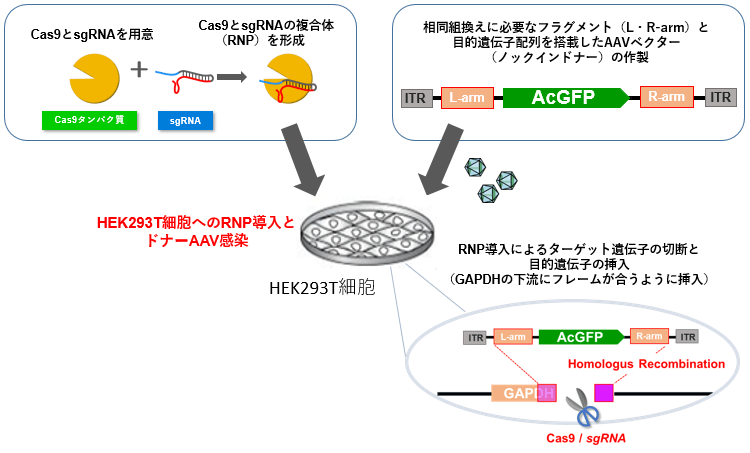
アデノ随伴ウイルス上のドナーDNAを用いた高効率ノックイン―ゲノム編集
【実験の流れ】
【方法】 ドナー AAVベクターの調製
- 試薬等の準備
-
AAV作製キット:AAVpro Helper Free System(AAV6)(製品コード 6651)
ライゲーションキット:DNA Ligation Kit <Mighty Mix>(製品コード 6023)
プラスミド調製キット:NucleoBond Xtra Midi(製品コード 740410.10など)
HEK293T細胞
トランスフェクション試薬:TransIT-293 Transfection Reagent(製品コード MIR2704)
AAVベクター力価測定キット:AAVpro Titration Kit(for Real Time PCR)Ver.2(製品コード 6233) - pAAV-CMV Vectorへの目的遺伝子のクローニングとベクタープラスミドの調製
- AAVpro Helper Free System(AAV6)のpAAV-CMV VectorをCla I処理することで、プロモーター領域からPoly A配列を除去し、ITRとITRの間に、相同組換えに必要なフラグメント(L・R-arm)とAcGFPを含むフラグメントを挿入した。クローニングにはDNA Ligation Kit<Mighty Mix>を用いた。その後、目的遺伝子を含むプラスミドを調製した。
- HEK293T細胞へのトランスフェクション
- 調製したベクタープラスミドとAAVpro Helper Free System(AAV6)中のpRC6 VectorおよびpHelper Vectorのプロトコールに従い、TransIT-293 Transfection Reagentを用いてトランスフェクションした。
- AAVベクターの回収
- トランスフェクションの翌日に培地を2%FBS含有DMEMに交換した。トランスフェクションから2日後に0.5 M EDTA(pH8.0)を終濃度6.25 mMとなるように培地に加えて細胞を剥離し、AAV Extraction Solutionを使用してベクターを抽出した。
- ウイルス力価の測定
- AAVpro Titration Kit (for Real Time PCR) Ver.2を用いて、AAVベクターの力価測定を実施した。
【方法】 ゲノム編集・感染
- 試薬等の準備
-
Cas9タンパク質:Guide-it Recombinant Cas9 (3 μg/μl)(製品コード 632641など)
sgRNA:Guide-it sgRNA In Vitro Transcription Kit(製品コード 632635)によりGAPDH遺伝子に対するsgRNAを調製
ドナーAAVベクター:調製したドナーAAVベクター
Cas9 Plasmid:Cas9発現プラスミド
sgRNA Plasmid:sgRNA発現プラスミド
ドナーPlasmid:L・R-armとAcGFP発現プラスミド
遺伝子導入機器:Neon Transfection System(Thermo Fisher Scientific社)- 1日目:ゲノム編集・感染
- 実験1.Cas9 PlasmidとsgRNA PlasmidとドナーPlasmidを使用
- ドナーPlasmid とsgRNA Plasmid、Cas9 Plasmidを混合する。
- HEK293T細胞を1×105 cells/10 μlになるように、1)の溶液で懸濁する。
- Neon Transfection Systemを用いてエレクトロポレーションを実施する。
- プレートに播種して、培地で培養する。
- Cas9タンパク質とsgRNAを加えピペッティングしてRNP溶液を調製する。
- RNP溶液を37℃で5分間インキュベート
- ドナーPlasmidを混合する。
- HEK293T細胞を1×105 cells/10 μlになるように、3)の溶液で懸濁する。
- Neon Transfection Systemを用いてエレクトロポレーションを実施する。
- プレートに播種して、培地で培養する。
- Cas9タンパク質とsgRNAを加えピペッティングしてRNP溶液を調製する。
- RNP溶液を37℃で5分間インキュベート
- HEK293T細胞を1×105 cells/10 μlになるように、2)の溶液で懸濁する。
- Neon Transfection Systemを用いてエレクトロポレーションを実施する。
- プレートに播種する。
- ドナーAAVベクターをMOI 900でプレートの細胞へ添加してAAVを感染させる。
- インキュベート
- 3~4日目:細胞の継代
- 細胞を剥離し継代
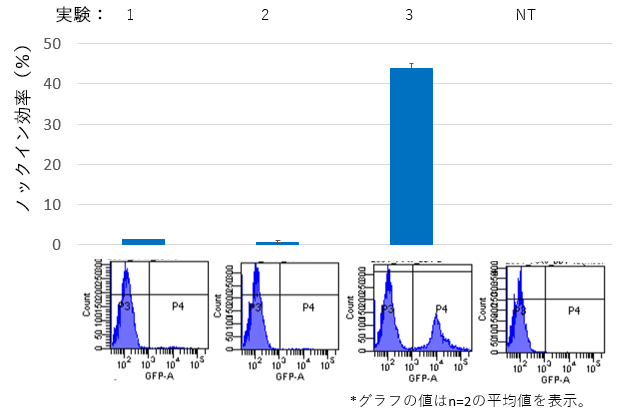
- 7日目:フローサイトメーターによるノックイン効率の測定
-
HEK293T細胞のAcGFP発現細胞の割合をFlow cytometryを用いて解析し、ノックイン効率を測定した。
NTは無処理の細胞を示す。
【結果】