特長
- ヒト幹細胞セルバンクに蓄積しうる、がん関連遺伝子の変異を全ゲノムシーケンス解析により確認
- 核酸抽出から情報解析までのパッケージサービス
- 挿入遺伝子の挿入位置解析、オフターゲット領域解析等のゲノム編集細胞株を対象とした情報解析にも対応
概要
ヒト細胞加工製品の製造に使用される細胞株は、細胞増殖の過程で変異を蓄積します。特にがん原遺伝子の変異は懸念すべきであり、FDA(アメリカ食品医薬品局)から2024年4月にヒト細胞由来セルバンクの安全性試験に関するドラフトガイダンス(Safety Testing of Human Allogeneic Cells Expanded for Use in Cell-Based Medical Products)が発行されています。このガイダンスでは、マスターセルバンクの安全性試験項目の1つとして、下記条件による全ゲノムシーケンス解析が推奨されています。
タカラバイオでは、NovaSeqシステム(ショートリード)もしくはRevioシステム(ロングリード)を用いた全ゲノムシーケンス解析によるヒト細胞由来セルバンクの安全性試験をご提供します。
- 少なくともシーケンス冗長度(Sequencing depth)50以上にてがん関連遺伝子変異を解析すること
- ゲノム編集により製造されたマスターセルバンクの場合は、少なくともシーケンス冗長度50以上にてオフターゲット、オンターゲット位置、ベクター挿入の同定、および変異解析を実施すること
タカラバイオでは、NovaSeqシステム(ショートリード)もしくはRevioシステム(ロングリード)を用いた全ゲノムシーケンス解析によるヒト細胞由来セルバンクの安全性試験をご提供します。
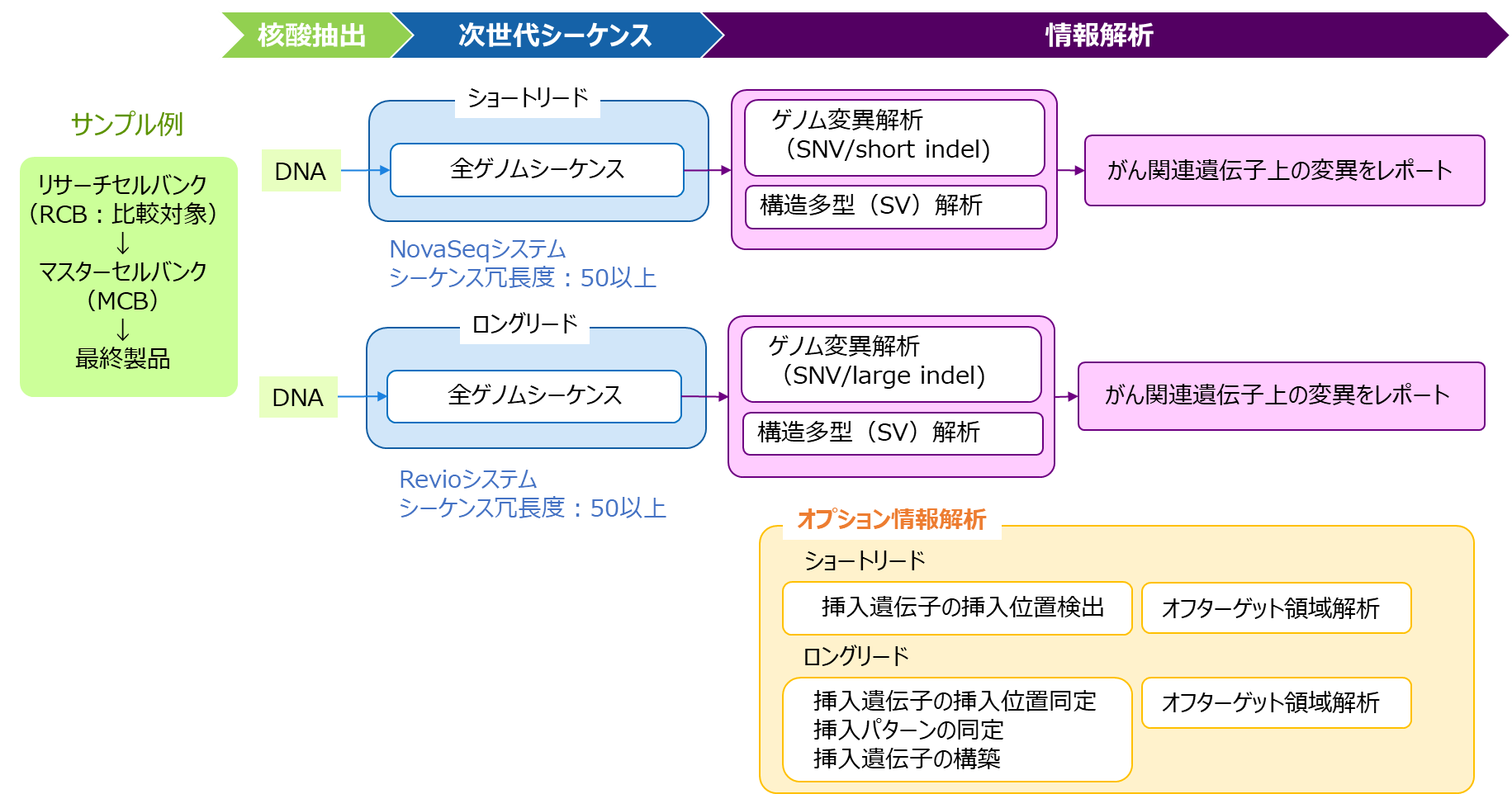

サービス内容
(基本仕様)
(オプション)
- 試験計画書作成
- ゲノムDNA抽出
- ライブラリー作製
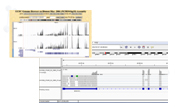
- 全ゲノムシーケンス(シーケンス冗長度:50以上)
- ショートリードシーケンスの場合:NovaSeqシステム 300 Gb/検体
- ロングリードシーケンスの場合:Revioシステム 2.5セル/検体
- ゲノム変異解析、構造多型解析
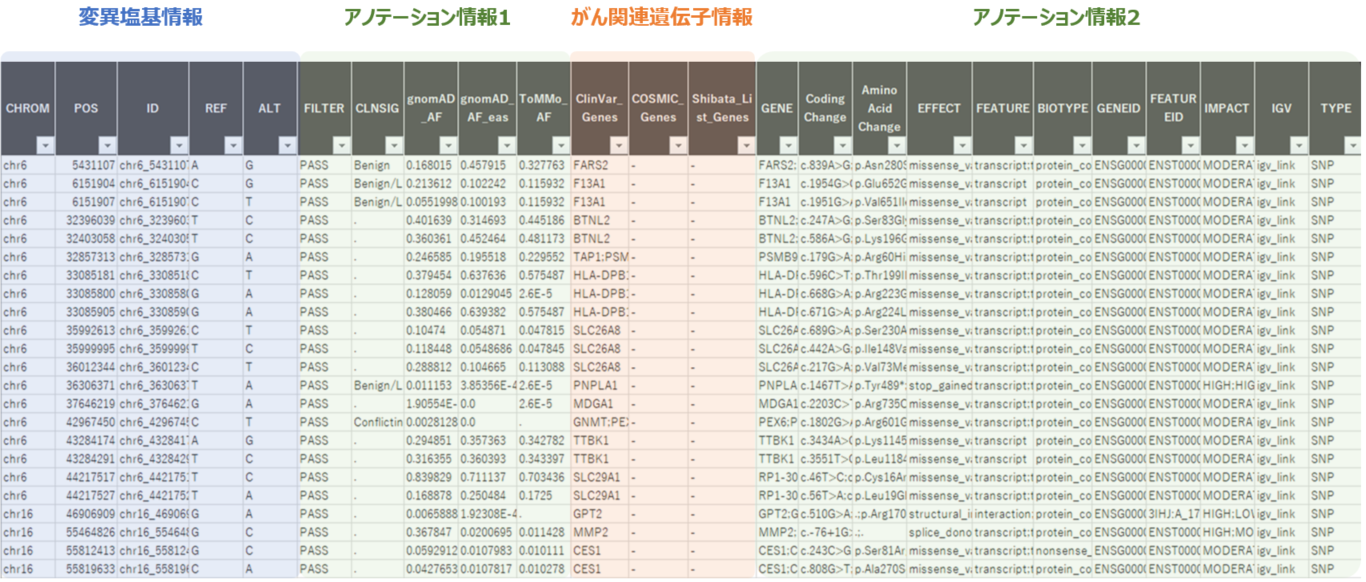
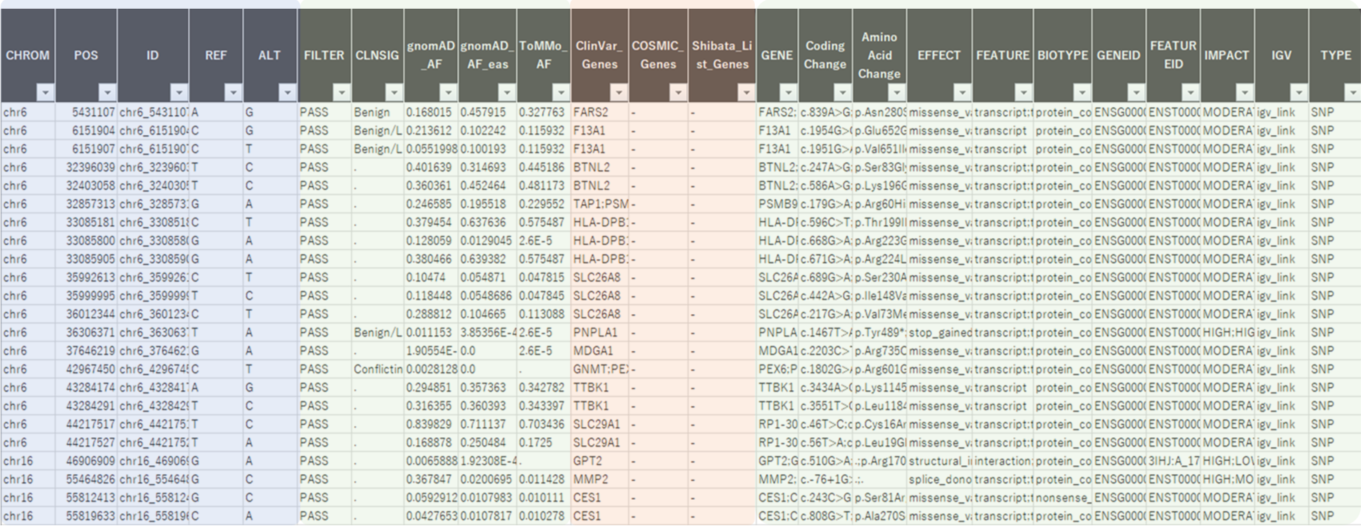
- がん関連遺伝子情報の付与
- COSMIC cancer database、shibata list、ClinVar(NCBI)に登録のある遺伝子情報をゲノム変異解析結果、構造多型解析結果に付与する。
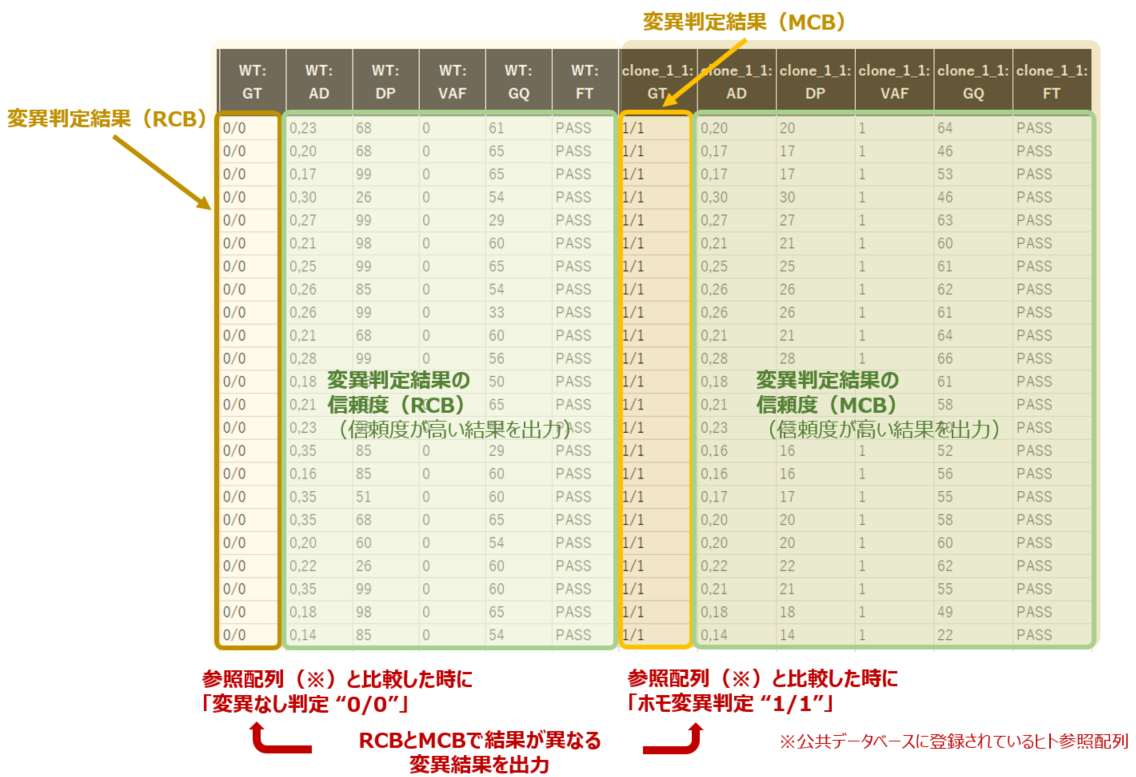
- マスターセルバンク特異的ながん関連遺伝子上の変異抽出
- 最終報告書作成
(オプション)
- 挿入遺伝子の挿入位置解析、オフターゲット領域解析
価格・納期
| 基本仕様 ※2検体(RCB 1検体、MCB 1検体)の場合 | 参考納期 | オプション(追加納期なし) | |
|---|---|---|---|
| ショートリード | \2,000,000/2検体 | ご依頼の内容により異なりますので、お問い合わせください。 | 挿入位置解析:\550,000 オフターゲット領域解析:\200,000 |
| ロングリード | \5,800,000/2検体 | 挿入位置解析:\500,000 オフターゲット領域解析:\450,000 |
納品物
- 試験計画書、最終報告書
- シーケンスデータ一式
- マッピング結果ファイル一式
- ゲノム変異解析結果、構造多型解析結果ファイル
- 最終レポート(マスターセルバンク特異的ながん関連遺伝子上の変異)
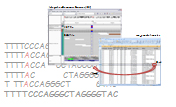
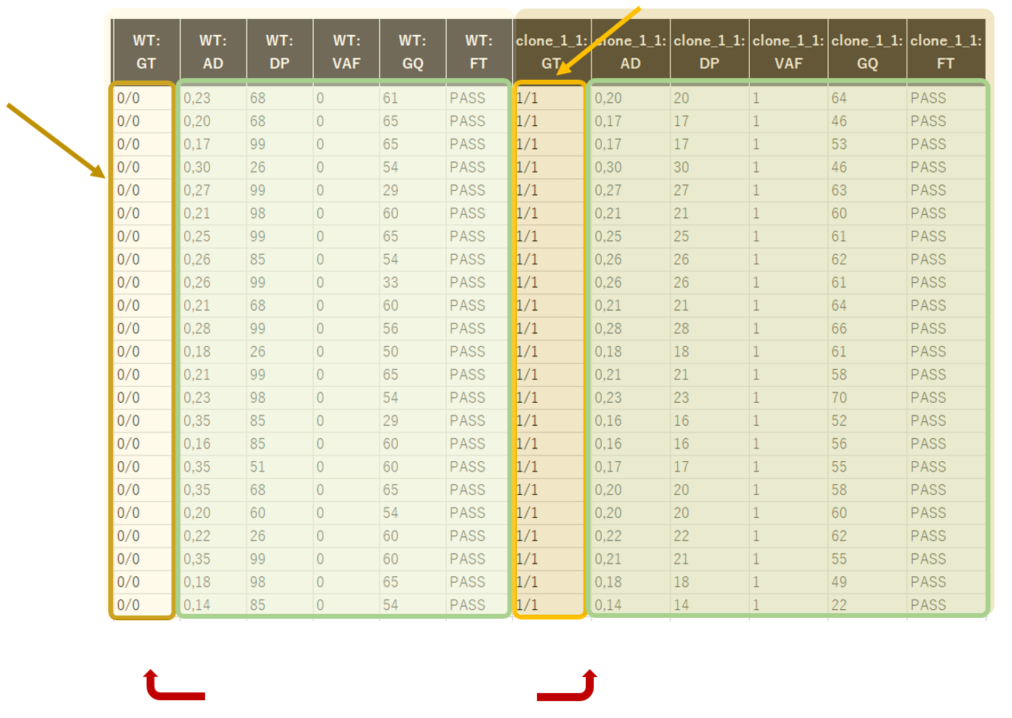
最終レポート例
ご注文方法
以下のフォーマットにご記入のうえ、電子メールにてこちらへご送付ください。
- 次世代シーケンス(NGS)解析発注依頼書(Excel)
- ヒトゲノム・遺伝子解析情報提供用紙(Excel) ※弊社「個人情報としてのゲノムデータの取り扱い」の詳細はこちらをご参照ください。
- 臨床検体又は供与細胞に関する情報提供用紙(Excel) ※臨床検体・細胞を送付いただく場合は、受託サービスをお申込みいただく前に、「臨床検体又は供与細胞に関する情報提供用紙」にご記入の上、弊社へお送りください。 弊社にてご提供いただいた情報を元にお取り扱いの可否を判断して折り返しご連絡いたします。
「臨床検体のお取り扱いについて」の詳細はこちらをご参照ください。
受入サンプル
- 参照配列情報
- 細胞、ゲノムDNA
ご留意事項
- ヒト試料の解析にあたり、個人情報に関わるサンプルは、お客様ご所属施設の倫理委員会等で遺伝子解析研究に用いられることの承認が得られており、かつお客様の元で匿名化されたものに限らせていただきます。
詳しくは、「ヒト試料・情報の取り扱いについて」をお読みください。 - お客様よりご提供いただいたサンプル・情報および納品物の複製物は、別途期限を定めている場合を除き、業務終了後3ヵ月を経過すると順次廃棄いたします。ご了承ください。
関連製品・受託
- 注意事項
- 本受託サービスは、個別に合意した場合を除き、すべて研究目的として作業を行います。納品物を試験研究目的以外へご使用される場合、弊社では納品物に起因する損失・損害等については一切の責任を負いかねます。納品物によっては、その構成物(例えば、ベクター、蛍光色素など)の使用に制限がある場合がありますのでご注意ください。
- 納品物に起因して、直接的もしくは間接的に発生したお客様の損害については、明らかに弊社の責に帰すべき事由による場合を除いて、弊社は一切その責任を負いません。
- ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。