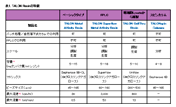
極めて高い特異性を提供するCobaltレジン
- ヒスチジンタグ融合タンパク質に対する高い結合性
- 他のタンパク質の混入のない高純度な精製
- 金属イオンの脱落がなく安心
- 様々な精製条件下で使用可能
製品説明
TALON ヒスチジンタグ(Hisタグ)融合タンパク質精製レジンは、コバルトを用いた固定化金属アフィニティクロマトグラフィ(IMAC)レジンである。コバルトはニッケルよりもHisタグ融合タンパク質に対して高い特異性を示すため、Hisタグ融合タンパク質を高純度に精製することができる。加えてコバルトイオンは4配位で結合しているため、金属イオンの脱落の心配がない。
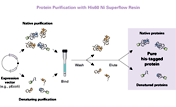
バクテリア、哺乳類、酵母、バキュロウイルス感染細胞などから、変性および未変性の両条件下でHisタグ融合タンパク質を高い純度で精製することができる。
コバルトを含む結合部位
TALON Metal Affinity Resinは結合部位にコバルトイオンを保持しており、コバルトイオンはHisタグ融合タンパク質に対して極めて高い特異性を有している。このコバルトを含んだTALONの結合部位は、ヒスチジンの空間的配置に対して厳密な要求性を持っており、ヒスチジンが連続した配列や、ヒスチジンが空間的に隣り合って並ぶ配列(6×HNタグ、HATタグなど)を持っているタンパク質のみがレジンに結合することができる。一方、ニッケルベースのレジン(Ni-NTAレジンなど)は、このような空間的要求性があまり厳密ではないため、タグだけではなく、ヒスチジンが不規則に並んだ配列も結合する。コバルトベースのTALONレジンはHisタグ融合タンパク質を極めて特異的に精製することができる。
均一なマトリックスによる金属イオンの保持
コバルトベースのレジンはニッケルベースのレジンより構造が均一である。TALONレジンには、陰イオンにチャージした三次元ポケット状の結合部位がある。このポケットの中で、3つのカルボキシル基と1つの窒素原子に、陽イオンのコバルト1分子が選択的に結合し、コバルトイオンは2つのヒスチジンと結合することができる。コバルトはこの立体構造によって強く結合しているため、レジンから漏出することはない。
一方、ニッケルイオンは2通りの配位構造を形成するため、ニッケルベースのレジンの構造はコバルトベースのレジンほど均一ではない。TALONと同様の三次元ポケットも形成するが、二次元構造(平面)も形成する。この歪んだ二次元構造では、ニッケルは2つだけのカルボキシル基と1つの窒素原子に結合している。この結合はあまり強固ではなく、ニッケルイオンを強く保持できないため、レジンからのニッケルイオンの漏出が起こる。
均一なマトリックスを形成するTALON Metal Affinity Resinは、種々の精製条件下で高い結合能力を持つため、確実にタンパク質を精製することができる。
コバルトを含む結合部位
TALON Metal Affinity Resinは結合部位にコバルトイオンを保持しており、コバルトイオンはHisタグ融合タンパク質に対して極めて高い特異性を有している。このコバルトを含んだTALONの結合部位は、ヒスチジンの空間的配置に対して厳密な要求性を持っており、ヒスチジンが連続した配列や、ヒスチジンが空間的に隣り合って並ぶ配列(6×HNタグ、HATタグなど)を持っているタンパク質のみがレジンに結合することができる。一方、ニッケルベースのレジン(Ni-NTAレジンなど)は、このような空間的要求性があまり厳密ではないため、タグだけではなく、ヒスチジンが不規則に並んだ配列も結合する。コバルトベースのTALONレジンはHisタグ融合タンパク質を極めて特異的に精製することができる。
均一なマトリックスによる金属イオンの保持
コバルトベースのレジンはニッケルベースのレジンより構造が均一である。TALONレジンには、陰イオンにチャージした三次元ポケット状の結合部位がある。このポケットの中で、3つのカルボキシル基と1つの窒素原子に、陽イオンのコバルト1分子が選択的に結合し、コバルトイオンは2つのヒスチジンと結合することができる。コバルトはこの立体構造によって強く結合しているため、レジンから漏出することはない。
一方、ニッケルイオンは2通りの配位構造を形成するため、ニッケルベースのレジンの構造はコバルトベースのレジンほど均一ではない。TALONと同様の三次元ポケットも形成するが、二次元構造(平面)も形成する。この歪んだ二次元構造では、ニッケルは2つだけのカルボキシル基と1つの窒素原子に結合している。この結合はあまり強固ではなく、ニッケルイオンを強く保持できないため、レジンからのニッケルイオンの漏出が起こる。
均一なマトリックスを形成するTALON Metal Affinity Resinは、種々の精製条件下で高い結合能力を持つため、確実にタンパク質を精製することができる。

図1. Hisタグ融合タンパク質に高い親和性と特異性を示すコバルトイオン
独自の四座配位キレート剤を含むTALON Metal Affinity Resinを用いて、セファロースCL-6B(ファルマシア)に各金属イオンを固定化した。各樹脂からの溶出液20 μlを、12%ポリアクリルアミドゲルで電気泳動しCoomassie Blueで染色した。
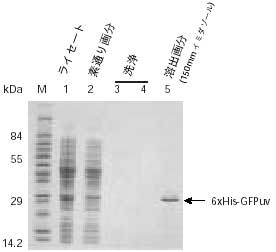
図2. 変性条件下における6xHis-GFPuvの精製
TALON Resinを用いて8 M尿素存在下でHisタグ融合タンパク質を精製した。M:分子量マーカー
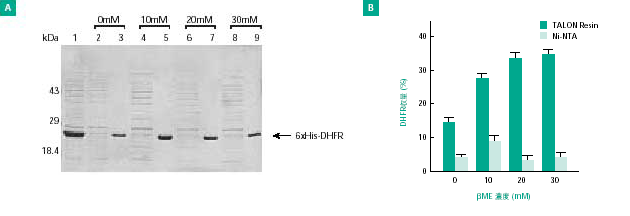
図3. TALON Resinを用いたβ-メルカプトエタノール(β-ME)存在下での6×His-DHFRの精製
パネルA:非変性条件での6×Hisタンパク質の精製。6×HisタグN末端融合マウスDHFR(19.5 kDa)を発現させた大腸菌ライセート2 mlを、TALON Resinを用いて、種々の濃度のβ-ME存在下で自然落下法にて精製した。偶数レーン:20 μlの非吸着画分 奇数レーン:5 μlの溶出画分
パネルB:非変性条件(β-ME存在下)で細胞抽出液から精製した組換え6×His-DHFRの収量をTALON ResinとNi-NTAで比較した。タンパク質濃度はBradfordアッセイにより測定した。収量は細胞ライセートの総タンパク質量に対する割合で示している。
 図4. TALON Metal Affinity Resin
|
 図5. TALON 2ml Disposable Gravity Columns TALON Metal Affinity Resinを充填して用いる空の使い捨てカラムである。 |
保存
TALON Metal Affinity Resin:4℃
Technical Notes
クロンテック製品の組合せ使用による簡単・迅速なタンパク質の発現と精製(日本語)
TALON®樹脂は還元剤としてβ-メルカプトエタノールが存在する非変性条件下でも6×Hisタグ融合タンパク質を精製できる(日本語)
TALON® Superflowを用いた迅速な1ステップIMAC精製(日本語)
HEK 293T 細胞で過剰発現したヒト・デオキシシチジンキナーゼ のTALON® 樹脂による精製とリン酸化部位の同定(日本語)
BIO VIEW / Clontechniques
Q&A: Clontech社TALON® レジン特集
ヒスチジンタグ融合タンパク質精製の切り札
TALON® Resin
Ni-NTA IMACで混入することが多い大腸菌由来のSlyDを結合しないTALON® Resin
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。