mRNA、sgRNA、siRNAなど、さまざまなタイプのRNAに最適なトランスフェクション試薬
- mRNAやCRISPR/Cas9のsgRNA、miRNA、siRNAなど、さまざまなタイプのRNAに最適なトランスフェクション試薬
- 広範な哺乳類細胞への遺伝子導入
- 高い遺伝子導入効率と極めて低い細胞毒性
- シンプルかつ血清培地にも対応したプロトコール
- トランスフェクションに必要な全てのコンポーネントを含んだAll-In-Oneシステム
製品説明
Xfect RNA Transfection Reagentは、広範な哺乳類細胞へさまざまなタイプのRNAを高効率に導入可能なトランスフェクション試薬である。
生分解性ナノ粒子からなるXfect RNA Transfection Reagentは、通常のトランスフェクション試薬で危惧される細胞毒性が低減されており、極めて低い細胞ダメージで哺乳類細胞へのトランスフェクションが可能である。
mRNAのトランスフェクションは、DNAトランスフェクションの際に懸念されるゲノムへの挿入変異がなく、迅速な導入遺伝子の発現が可能である。また、本製品はCRISPR/Cas9によるゲノム編集に必要なsgRNA導入を高効率に行うことが可能である。
更に、Xfect Transfection Reagent(製品コード 631317、631318)と組み合わせてDNAとRNAのコトランスフェクションを行うことも可能である。
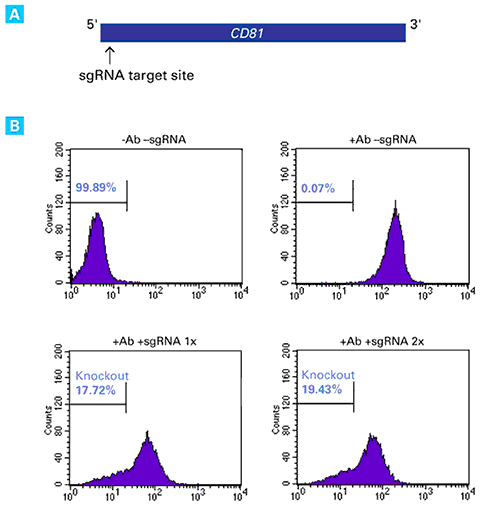
図1.sgRNAのトランスフェクションによる内在性CD81の機能的ノックアウト
CD81遺伝子5’末端領域のアンチセンス鎖側の配列を標的とするsgRNAを設計し、Guide-it sgRNA In Vitro Transcription Kit(製品コード 632635)を用いてsgRNAを合成した(図A)。
Xfect RNA Transfection Reagentを用いてCas9安定発現HT1080細胞株(HT1080-Cas9)2.0×105個に、CD81を標的としたsgRNA 50 pmolを1回、あるいは2回トランスフェクションした。トランスフェクションから7日後、FITC標識抗CD81抗体を用いて細胞を免疫染色し、フローサイトメトリー解析を行って、抗CD81抗体が結合しなかった細胞の割合を示した。コントロールとして、トランスフェクションも抗体染色も行わない細胞(図B左上)、抗体染色のみを行った細胞(図B右上)についてもフローサイトメトリー解析を行った。sgRNAのトランスフェクションを1回行った細胞(図B左下)、2回行った細胞(図B右下)とも、抗CD81抗体に結合しない細胞の割合が増加し、CRISPR/Cas9によるCD81のノックアウトが機能していることが示された。
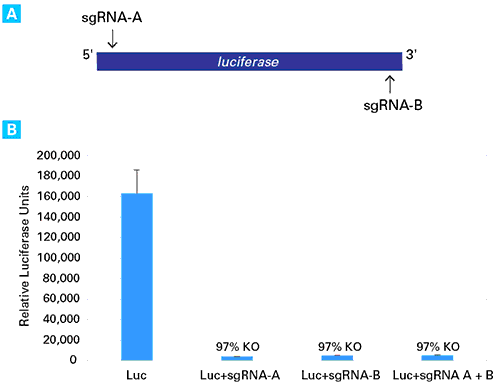
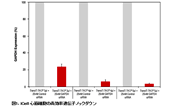
図2.sgRNAのトランスフェクションによるルシフェラーゼ遺伝子のノックアウト
ルシフェラーゼのセンス鎖とアンチセンス鎖を標的とした2つのsgRNAの(sgRNA-AとsgRNA-B)を設計し、Guide-it sgRNA In Vitro Transcription Kit(製品コード 632635)を用いてsgRNAを合成した(図A)。3.0×105個のCas9安定発現HT1080細胞株(HT1080-Cas9)を12well plateに培養し、Xfect Transfection Reagentを用いてルシフェラーゼ発現プラスミド(pCMV-Luc, 1 μg)をトランスフェクション後、さらに、Xfect RNA Transfection Reagentを用いてsgRNA-A(200 ng)、sgRNA-B(200 ng)、sgRNA-A(100 ng)とsgRNA-B(100 ng)の混合物をそれぞれトランスフェクションした。トランスフェクションから48時間後、ルシフェラーゼアッセイにより導入遺伝子の活性を測定した。その結果、sgRNAを導入した全てのサンプルにつきルシフェラーゼ活性の高効率なノックアウトが確認できた。(図B)
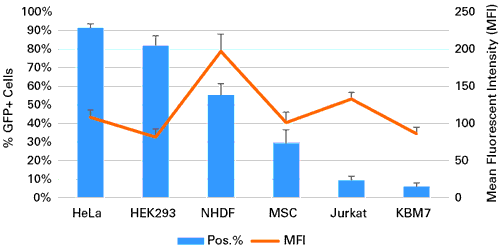
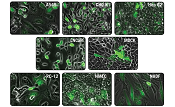
図3.初代培養細胞と株化細胞へのmRNAのトランスフェクションによるGFPの発現
HeLa細胞(2.0×105個)、HEK 293 細胞 (1.5×105個)、ヒト皮膚線維芽細胞(NHDF)(6.0×104個)、ヒト間葉系幹細胞(MSCs)(5.0×104個)、Jurkat細胞(3.0×105個)、KBM7細胞(3.0×105個)を12 well plateに培養し、GFPをコードするmRNA 1 μgを5 μlのXfect RNA Transfection Reagentを用いてトランスフェクションした。20時間後、フローサイトメトリー解析によって検出を行い、GFP発現細胞の割合(%)と平均蛍光強度(MFI)を決定した。
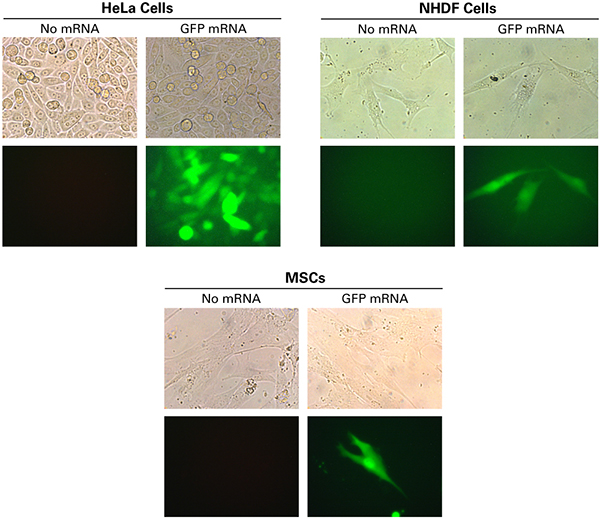
図4.HeLa細胞、ヒト皮膚線維芽細胞(NHDF)およびヒト間葉系幹細胞(MSCs)のGFPの発現
HeLa細胞(2.0×105個)、ヒト皮膚線維芽細胞(NHDF)(6.0×104個)、ヒト間葉系幹細胞(MSCs)(5.0×104個)を12 well plateに培養し、GFPをコードするmRNA 1 μgを5 μlのXfect RNA Transfection Reagentを用いてトランスフェクションした。20時間後、蛍光顕微鏡を用いて細胞の画像を取得した。HeLa細胞の画像は20倍の倍率で撮影し、NHDF細胞とMSCs細胞は40倍で撮影した。
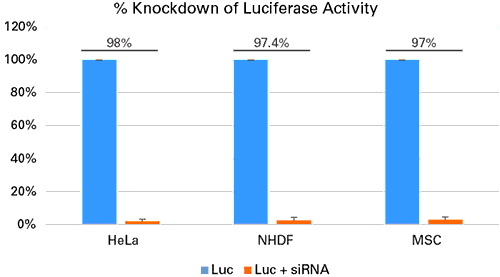
図5.siRNAを添加した初代培養細胞と株化細胞のノックダウンの成功例
HeLa細胞(2.0×105個)、ヒト皮膚線維芽細胞(NHDF)(6.0×104個)、ヒト間葉系幹細胞(MSCs)(5.0×104個)を12 well plateに培養し、ルシフェラーゼに対するsiRNA 50 pmolをXfect RNA Transfection Reagentを用いてトランスフェクションした。また3種の細胞にXfect Transfection Reagentを用いて1 μgのpCMV-Lucをトランスフェクションし、48時間後、ルシフェラーゼアッセイを行った。コントロールサンプルとして、細胞にpCMV-Lucのみをトランスフェクションしたサンプルを用意した。siRNAを添加した全ての細胞でルシフェラーゼ活性が劇的に減少した。
生分解性ナノ粒子からなるXfect RNA Transfection Reagentは、通常のトランスフェクション試薬で危惧される細胞毒性が低減されており、極めて低い細胞ダメージで哺乳類細胞へのトランスフェクションが可能である。
mRNAのトランスフェクションは、DNAトランスフェクションの際に懸念されるゲノムへの挿入変異がなく、迅速な導入遺伝子の発現が可能である。また、本製品はCRISPR/Cas9によるゲノム編集に必要なsgRNA導入を高効率に行うことが可能である。
更に、Xfect Transfection Reagent(製品コード 631317、631318)と組み合わせてDNAとRNAのコトランスフェクションを行うことも可能である。

図1.sgRNAのトランスフェクションによる内在性CD81の機能的ノックアウト
CD81遺伝子5’末端領域のアンチセンス鎖側の配列を標的とするsgRNAを設計し、Guide-it sgRNA In Vitro Transcription Kit(製品コード 632635)を用いてsgRNAを合成した(図A)。
Xfect RNA Transfection Reagentを用いてCas9安定発現HT1080細胞株(HT1080-Cas9)2.0×105個に、CD81を標的としたsgRNA 50 pmolを1回、あるいは2回トランスフェクションした。トランスフェクションから7日後、FITC標識抗CD81抗体を用いて細胞を免疫染色し、フローサイトメトリー解析を行って、抗CD81抗体が結合しなかった細胞の割合を示した。コントロールとして、トランスフェクションも抗体染色も行わない細胞(図B左上)、抗体染色のみを行った細胞(図B右上)についてもフローサイトメトリー解析を行った。sgRNAのトランスフェクションを1回行った細胞(図B左下)、2回行った細胞(図B右下)とも、抗CD81抗体に結合しない細胞の割合が増加し、CRISPR/Cas9によるCD81のノックアウトが機能していることが示された。

図2.sgRNAのトランスフェクションによるルシフェラーゼ遺伝子のノックアウト
ルシフェラーゼのセンス鎖とアンチセンス鎖を標的とした2つのsgRNAの(sgRNA-AとsgRNA-B)を設計し、Guide-it sgRNA In Vitro Transcription Kit(製品コード 632635)を用いてsgRNAを合成した(図A)。3.0×105個のCas9安定発現HT1080細胞株(HT1080-Cas9)を12well plateに培養し、Xfect Transfection Reagentを用いてルシフェラーゼ発現プラスミド(pCMV-Luc, 1 μg)をトランスフェクション後、さらに、Xfect RNA Transfection Reagentを用いてsgRNA-A(200 ng)、sgRNA-B(200 ng)、sgRNA-A(100 ng)とsgRNA-B(100 ng)の混合物をそれぞれトランスフェクションした。トランスフェクションから48時間後、ルシフェラーゼアッセイにより導入遺伝子の活性を測定した。その結果、sgRNAを導入した全てのサンプルにつきルシフェラーゼ活性の高効率なノックアウトが確認できた。(図B)

図3.初代培養細胞と株化細胞へのmRNAのトランスフェクションによるGFPの発現
HeLa細胞(2.0×105個)、HEK 293 細胞 (1.5×105個)、ヒト皮膚線維芽細胞(NHDF)(6.0×104個)、ヒト間葉系幹細胞(MSCs)(5.0×104個)、Jurkat細胞(3.0×105個)、KBM7細胞(3.0×105個)を12 well plateに培養し、GFPをコードするmRNA 1 μgを5 μlのXfect RNA Transfection Reagentを用いてトランスフェクションした。20時間後、フローサイトメトリー解析によって検出を行い、GFP発現細胞の割合(%)と平均蛍光強度(MFI)を決定した。

図4.HeLa細胞、ヒト皮膚線維芽細胞(NHDF)およびヒト間葉系幹細胞(MSCs)のGFPの発現
HeLa細胞(2.0×105個)、ヒト皮膚線維芽細胞(NHDF)(6.0×104個)、ヒト間葉系幹細胞(MSCs)(5.0×104個)を12 well plateに培養し、GFPをコードするmRNA 1 μgを5 μlのXfect RNA Transfection Reagentを用いてトランスフェクションした。20時間後、蛍光顕微鏡を用いて細胞の画像を取得した。HeLa細胞の画像は20倍の倍率で撮影し、NHDF細胞とMSCs細胞は40倍で撮影した。

図5.siRNAを添加した初代培養細胞と株化細胞のノックダウンの成功例
HeLa細胞(2.0×105個)、ヒト皮膚線維芽細胞(NHDF)(6.0×104個)、ヒト間葉系幹細胞(MSCs)(5.0×104個)を12 well plateに培養し、ルシフェラーゼに対するsiRNA 50 pmolをXfect RNA Transfection Reagentを用いてトランスフェクションした。また3種の細胞にXfect Transfection Reagentを用いて1 μgのpCMV-Lucをトランスフェクションし、48時間後、ルシフェラーゼアッセイを行った。コントロールサンプルとして、細胞にpCMV-Lucのみをトランスフェクションしたサンプルを用意した。siRNAを添加した全ての細胞でルシフェラーゼ活性が劇的に減少した。
内容
| ・Xfect RNA Transfection Polymer | 600 μl×2 |
| ・Xfect Reaction Buffer | 12 ml×2 |
* 12ウェルプレートの240ウェル分の反応液
保存
-20℃
いったん融解したものは4℃保存し、12ヵ月以内にご使用ください。
いったん融解したものは4℃保存し、12ヵ月以内にご使用ください。
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。