汎用トランスフェクション試薬
- DNAやsiRNA/miRNAをさまざまな細胞種に高効率に導入可能
- 低細胞毒性で培地交換が不要
- 動物由来成分フリー
- 正常初代細胞にも使用可能
- Cas9とsgRNA複合体(RNP)の導入にも使用可能
- TransIT-X2とCas9タンパク質の組み合わせによる効率的なゲノム編集の実験例
製品説明
TransIT-X2 Dynamic Delivery Systemは、初代細胞を含む様々な細胞に、DNAおよびsiRNA/miRNAを高効率に導入するためのトランスフェクション試薬です(図1、2、3)。本試薬は、DNAとsiRNAのコトランスフェクションにも使用することができます(図4)。
本試薬の細胞毒性は低く、トランスフェクション後の培地交換は必要ありません。また、血清を含む培地中でも使用することができます。
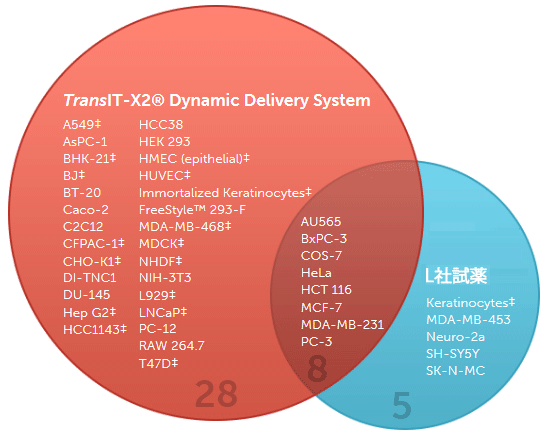
図1. TransIT-X2 Dynamic Delivery Systemは様々な細胞で高い遺伝子発現レベルを示す
TransIT-X2またはL社試薬を用いてルシフェラーゼ発現プラスミドDNAを各細胞にトランスフェクションし、24時間後にルシフェラーゼアッセイを行った。41種類の細胞のうち36種類の細胞で、TransIT-X2はL社試薬と同等以上の結果を示した。‡を付した細胞では、比較した試薬使用の場合の2倍以上の発現レベルを得ることができた。
細胞タイプ別推奨プロトコールは下記をクリック
https://hub.mirusbio.com/m/d6a018920beec12e/original/Protocol-Optimization-Card.pdf
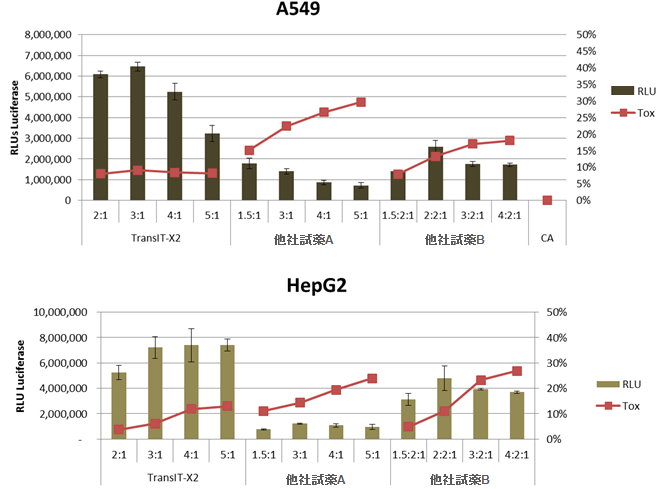
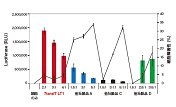
図2. 高い発現効率と低い細胞毒性
ヒト肺胞基底上皮腺癌細胞(A549)またはヒト肝癌由来細胞(HepG2)にTransIT-X2と他社トランスフェクション試薬A,Bを用いて、ルシフェラーゼ発現プラスミドをトランスフェクションした。横軸には、試薬:DNA比を示す。トランスフェクションは、96ウェルプレートで0.1 μgプラスミドを使用した。ルシフェラーゼ発現(棒グラフ)とLDH活性レベル(折れ線、%細胞傷害性)はトランスフェクション24時間後に測定した。
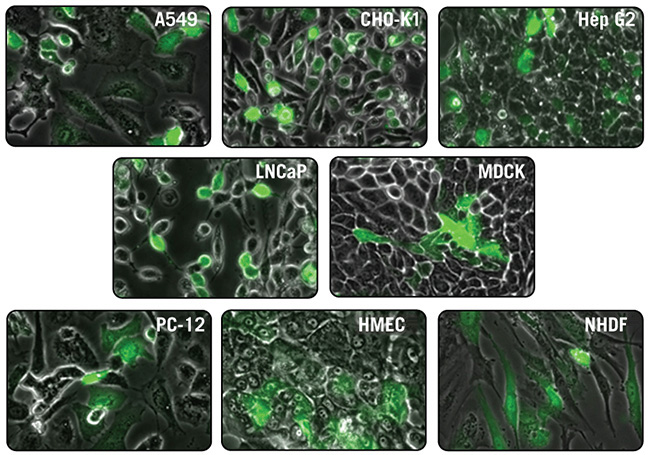
図3. TransIT-X2 Dynamic Delivery Systemを用いたGFP発現プラスミドDNAのトランスフェクション
TransIT-X2 Dynamic Delivery Systemを用いてEGFP発現プラスミドDNAをA549、CHO-K1、HepG2、LNCaP、MDCK、PC12、ヒト乳腺上皮細胞(HMEC)及び正常ヒト皮膚線維芽細胞(NHDF)それぞれにトランスフェクションした。35 mm dish(MatTek社)で培養した細胞に対し、4~8 μlの試薬と2 μgのDNAを使用した。トランスフェクション48時間後、倒立型蛍光顕微鏡により観察を行った。
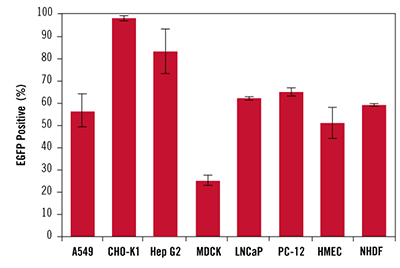
図4. TransIT-X2 Dynamic Delivery Systemを用いた各種培養細胞および初代細胞への高効率トランスフェクション
TransIT-X2 Dynamic Delivery Systemを用いて、A549、CHO-K1、Hep G2、MDCK、LNCaP、PC-12、ヒト乳腺上皮細胞(HMEC)及び正常ヒト皮膚線維芽細胞(NHDF)にEGFP発現プラスミドDNAをトランスフェクションした。96 wellプレートで培養した細胞に対し 0.2~0.4 μlの試薬と0.1 μgのDNA(試薬:DNA比2:1、3:1または4:1)を用いてトランスフェクションを行い、48時間後にフローサイトメーターを用いて3ウェル分の測定を行った。
本試薬の細胞毒性は低く、トランスフェクション後の培地交換は必要ありません。また、血清を含む培地中でも使用することができます。

図1. TransIT-X2 Dynamic Delivery Systemは様々な細胞で高い遺伝子発現レベルを示す
TransIT-X2またはL社試薬を用いてルシフェラーゼ発現プラスミドDNAを各細胞にトランスフェクションし、24時間後にルシフェラーゼアッセイを行った。41種類の細胞のうち36種類の細胞で、TransIT-X2はL社試薬と同等以上の結果を示した。‡を付した細胞では、比較した試薬使用の場合の2倍以上の発現レベルを得ることができた。
細胞タイプ別推奨プロトコールは下記をクリック
https://hub.mirusbio.com/m/d6a018920beec12e/original/Protocol-Optimization-Card.pdf

図2. 高い発現効率と低い細胞毒性
ヒト肺胞基底上皮腺癌細胞(A549)またはヒト肝癌由来細胞(HepG2)にTransIT-X2と他社トランスフェクション試薬A,Bを用いて、ルシフェラーゼ発現プラスミドをトランスフェクションした。横軸には、試薬:DNA比を示す。トランスフェクションは、96ウェルプレートで0.1 μgプラスミドを使用した。ルシフェラーゼ発現(棒グラフ)とLDH活性レベル(折れ線、%細胞傷害性)はトランスフェクション24時間後に測定した。

図3. TransIT-X2 Dynamic Delivery Systemを用いたGFP発現プラスミドDNAのトランスフェクション
TransIT-X2 Dynamic Delivery Systemを用いてEGFP発現プラスミドDNAをA549、CHO-K1、HepG2、LNCaP、MDCK、PC12、ヒト乳腺上皮細胞(HMEC)及び正常ヒト皮膚線維芽細胞(NHDF)それぞれにトランスフェクションした。35 mm dish(MatTek社)で培養した細胞に対し、4~8 μlの試薬と2 μgのDNAを使用した。トランスフェクション48時間後、倒立型蛍光顕微鏡により観察を行った。

図4. TransIT-X2 Dynamic Delivery Systemを用いた各種培養細胞および初代細胞への高効率トランスフェクション
TransIT-X2 Dynamic Delivery Systemを用いて、A549、CHO-K1、Hep G2、MDCK、LNCaP、PC-12、ヒト乳腺上皮細胞(HMEC)及び正常ヒト皮膚線維芽細胞(NHDF)にEGFP発現プラスミドDNAをトランスフェクションした。96 wellプレートで培養した細胞に対し 0.2~0.4 μlの試薬と0.1 μgのDNA(試薬:DNA比2:1、3:1または4:1)を用いてトランスフェクションを行い、48時間後にフローサイトメーターを用いて3ウェル分の測定を行った。
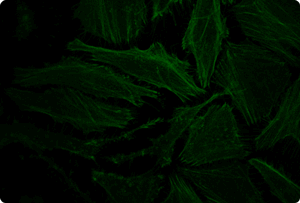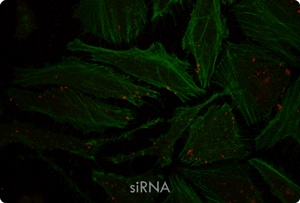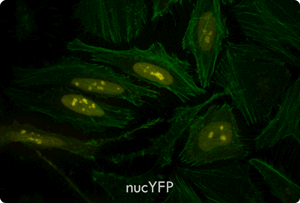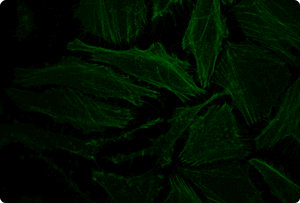
図5. TransIT-X2 Dynamic Delivery Systemを用いたプラスミドDNAとsiRNAのコトランスフェクション
Cy5標識した核局在性YFP発現プラスミドとCy3標識したsiRNAをHeLa細胞へコトランスフェクションした。トランスフェクションは6 wellプレート(ポリ-L-リジンコートのカバーガラスを含む)で4 μlの試薬と2 μgのDNAおよび25 nMのsiRNA(試薬:DNA比=2:1)を用いて行った。アクチンフィラメントをAlexa Fluor 350 Phalloidinにより染色した。トランスフェクション24時間後、共焦点顕微鏡により観察を行った(倍率63倍)。
黄:核局在性YFP、青:Cy5標識DNA、赤:Cy3標識siRNA、緑:アクチンフィラメント
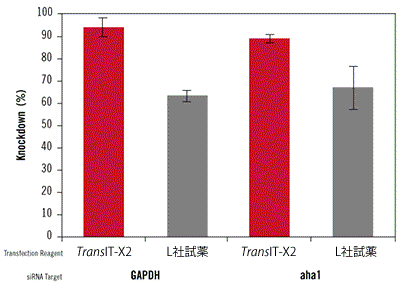
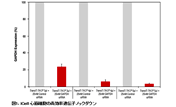
図6. TransIT-X2 Dynamic Delivery SystemとL社試薬を用いたsiRNAのノックダウン効率の比較
GAPDHおよびaha1に対するsiRNAとネガティブコントロールsiRNAをTransIT-X2 Dynamic Delivery SystemまたはL社試薬を用いて正常ヒト皮膚線維芽細胞(NHDF)にトランスフェクションした。トランスフェクションは6 wellプレートを用いて行い、4 μlのTransIT-X2または6 μlのL社試薬を使用し、25 nMのsiRNAを各試薬の説明書に従って細胞へトランスフェクションした。48時間後、リアルタイム定量PCRにて18s rRNAに対するGAPDHおよびaha1の相対発現量を測定し、ネガティブコントロールによりノーマライズを行った。
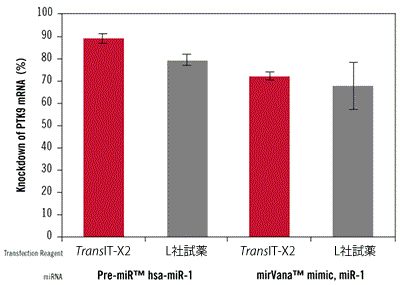
図7. TransIT-X2 Dynamic Delivery SystemとL社試薬を用いたPTK9をターゲットとするmiRNAのノックダウン効率の比較
TransIT-X2またはL社試薬を用いてPre-miR hsa-miR-1 miRNA Precursor またはmirVana miRNA mimic, miR-1をT47D細胞にトランスフェクションした。どちらのmiRNAもPTK9 mRNAの発現量を低下させることが知られている。12 wellプレートを使用し、3 μlのTransIT-X2またはL社試薬を使用して50 nM miRNAをT47D細胞へトランスフェクションした。mRNAレベルのベースラインを評価するため、Pre-miRネガティブコントロールをトランスフェクションした。プロトコールは各試薬の説明書に従った。48時間後、リアルタイム定量PCRを行いPTK9の発現量を18s rRNAを用いた相対比較により測定し、ネガティブコントロールのmRNA発現量によりノーマライズを行った。
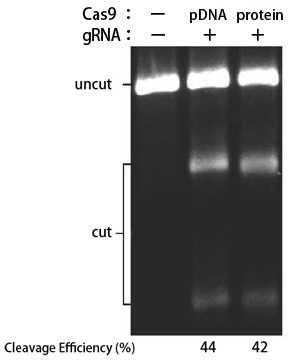
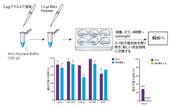
図8. TransIT-X2 Dynamic Delivery Systemを用いたゲノム編集実験
TransIT-X2を用いて、293T/17細胞にCas9発現プラスミドDNA/gRNA、または、Cas9タンパク質/gRNA(RNP複合体)をトランスフェクションし、human PPIB(Peptidylprolyl Isomerase B(Cyclophilin B))をターゲットとするゲノム編集を行った。トランスフェクション48時間後に、T7E1アッセイを行い、Indel(塩基の欠失と挿入) の割合を算出した。
保存
-20℃
トランスフェクション試薬選択 オンラインツール
◆検索ツール
| “Reagent Agent”は、Mirus社が提供するトランスフェクション試薬の検索ツールです。 細胞と導入する核酸の種類から、推奨されるトランスフェクション試薬を検索することができます。 |

|
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。