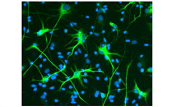
製品説明
NDiff 227培地は、接着単層培養条件下のマウスES細胞を神経細胞へ分化させるための完全合成、無血清培地である(組成は非公開)。本培地は、添加因子を加えることにより、マウスES細胞の無血清、フィーダー細胞非存在下での培養にも使用できる(参考文献2)。さらに増殖因子を添加することにより、ヒトES細胞の培養(参考文献3,4)や、ground-stateでのヒトiPS細胞培養(参考文献6)にも利用できる。
FGFを添加することにより、NDiff 227培地はマウスES細胞から、肝臓や膵臓へ分化できるADE(Anterior Definitive Endoderm)前駆体を生じることも可能である(参考文献5)。
FGFを添加することにより、NDiff 227培地はマウスES細胞から、肝臓や膵臓へ分化できるADE(Anterior Definitive Endoderm)前駆体を生じることも可能である(参考文献5)。
保存
-20℃(融解後は4℃で保存し、4週間以内に使用する)
必ず遮光して保存すること。
必ず遮光して保存すること。

アプリケーション
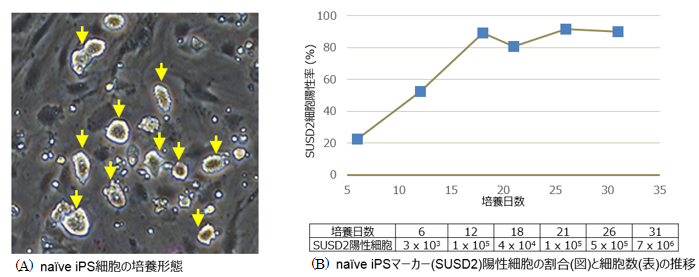
NDiff227を用いた培養法(培養プロトコールの詳細はこちら)にて、ヒトiPS細胞株 Cellartis human iPS cell line 18 (ChiPSC18)(製品コード Y00305)のnaïve化と維持培養を行ったところ、培養18日目に矢印の培養形態を示した(図A)。また、naïve iPSマーカー(SUSD2)陽性細胞が得られ、 培養18日目以降、80%を超える高いnaïve iPSマーカー陽性率で維持することができた(図B)。
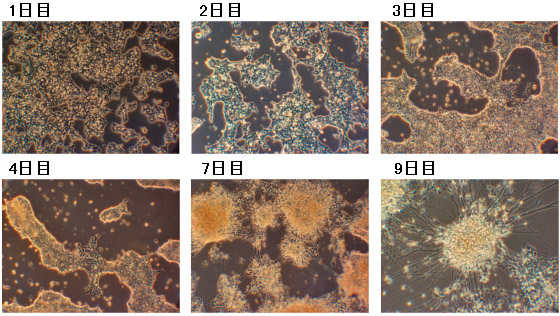
マウスES細胞から神経細胞への分化を下記培養例に従って行った。
<培養例>
- 継代数の少ない、フィーダー細胞非依存性のES細胞を2.5~10×103 cells/cm2の密度でゼラチンコートプレートにNDiff 227培地を用いて播種する。
- 1~2日ごとに培地交換する。神経細胞への分化の初期段階で、かなりの数の死細胞が観察される。
- 神経細胞への分化を形態観察、またマーカーの発現などで観察する。神経細胞への分化は4~6日目から観察され、7~9日目にニューロン成熟が見られる。
注意:上記条件は標準的なものであり、各細胞株によって条件検討が必要である。
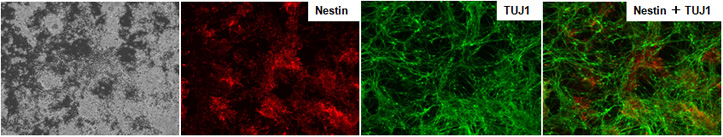
NDiff227培地で培養したマウスES細胞E14Tg2A(培養9日目)は神経細胞に分化していることが確認できた。
使用例
マウスES細胞の神経細胞への分化
- 継代数の少ない、フィーダー細胞非依存性のES細胞を2.5~10×103 cells/cm2の密度でゼラチンコートプレートにNDiff 227培地を用いて播種する。
- 1~2日ごとに培地交換する。神経細胞への分化の初期段階で、かなりの数の死細胞が観察される。
- 神経細胞への分化を形態観察、またマーカーの発現などで観察する。神経細胞への分化は4~6日目から観察され、7~9日目にニューロン成熟が見られる。
注意:上記条件は標準的なものであり、各細胞株によって条件検討が必要である。
使用文献
Autotaxin-mediated lipid signaling intersects with LIF and BMP signaling to promote the naive pluripotency transcription factor program
Cody K, Masayo S-Y, Leeanne G, Yohei H, Salma S, Rik D, Michio A, Barbara P, Shinya Y, Kiichiro T (2016) PNAS 113(44): 12478-12483
Cody K, Masayo S-Y, Leeanne G, Yohei H, Salma S, Rik D, Michio A, Barbara P, Shinya Y, Kiichiro T (2016) PNAS 113(44): 12478-12483
参考文献
- Conversion of embryonic stem cells into neuroectodermal precursors in adherent monoculture.
Ying QL, Stavridis M, Griffiths D, Li M, Smith A (2003) Nature Biotechnology 21:183-186. - BMP induction of Id proteins suppresses differentiation and sustains embryonic stem cell self‐renewal in collaboration with STAT3.
Ying QL, Nichols J, Chambers I, Smith A (2003) Cell 115:281-292. - Expansion of Human Embryonic Stem Cells in Defined Serum‐Free Medium Devoid of Animal‐Derived Products.
Li Y, et al. (2005) Biotechnology and Bioengineering 91:688-698. - Long‐term self‐renewal and directed differentiation of human embryonic stem cells in chemically defined conditions.
Yao S, et al. (2006) PNAS 103(18):6907-6912. - Anterior Definitive Endoderm from ESCs reveals a role for FGF signaling.
Morrison G, Oikonomopoulou I, Portero Migueles R, Soneji S, Livigni A, Enver T, Brickman J (2008) Cell Stem Cell 3:402-415. - Resetting transcription factor control circuitry toward ground-state pluripotency in human.
Takashima Y, et al. (2014) Cell 158(6):1254-1269.
関連資料
関連のオンラインガイドはこちら
幹細胞・再生医療研究ガイド
タカラバイオで展開している幹細胞研究のための試薬・受託サービス選択ガイドの他、関連情報をまとめています。
タカラバイオで展開している幹細胞研究のための試薬・受託サービス選択ガイドの他、関連情報をまとめています。
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。