SARS-CoV-2スパイクタンパク質エンベロープを持つシュードタイプレンチウイルスの作製に
- 高タイターのSARS-CoV-2シュードウイルス溶液の作製*1が可能
- レンチウイルスベクタープラスミド溶液*2を加え、293T細胞に添加するだけの簡便プロトコール
- トランスフェクション試薬が不要
- コートするスパイクタンパク質エンベロープは、野生型、変異型(それぞれ全長もしくはTruncated)から選択
- Packaging Mixのみの単品購入も可能
*2 Lenti-X Reporter Vector Set(pLVXS-ZsGreen1 / Luciferase-Puro Vector)につきまして、不足分は大腸菌で増やしてお使いください。
製品説明
SARS-CoV-2の宿主細胞への感染メカニズムの研究には、しばしばSARS-CoV-2スパイクタンパク質でシュードタイピングされた代替ウイルスが使用されます。
Lenti-X SARS-CoV-2 Packaging Single Shotsは、SARS-CoV-2のスパイクタンパク質エンベロープを持つシュードタイプレンチウイルスを簡便に作製するためのパッケージングシステムで、2つのタイプの製品が用意されています。
Lenti-X SARS-CoV-2 Packaging Single Shotsはプレミックスタイプの製品で、トランスフェクション試薬Xfect Transfection Reagentと、SARS-CoV-2スパイクタンパク質を発現するパッケージングプラスミドが1本のチューブ内にプレミックスされています。レンチウイルスベクタープラスミド溶液を添加して静置後、10 cmディッシュ中のLenti-X 293T Cell Line(製品コード 632180)に添加するだけで、高タイターのSARS-CoV-2シュードウイルスを作製することができます。
シュードウイルスの宿主細胞への遺伝子導入効率は、ベクタープラスミドに組み込まれているレポーター(ZsGreen1もしくはルシフェラーゼ)で検証可能です。
宿主細胞にはHuman ACE2 293T Cell Line(製品コード 631289)などが利用できます。
プレミックスタイプのLenti-X SARS-CoV-2 Packaging Single Shotsは、シュードウイルスにコートさせるSARS-CoV-2スパイクタンパク質を、以下の2種類から選択可能です。
単品のPackaging Mixは、上記2種類に加えて以下の4種類からも選択可能です。
(注)
Lenti-X SARS-CoV-2 Packaging Single Shotsは、SARS-CoV-2のスパイクタンパク質エンベロープを持つシュードタイプレンチウイルスを簡便に作製するためのパッケージングシステムで、2つのタイプの製品が用意されています。
Lenti-X SARS-CoV-2 Packaging Single Shotsはプレミックスタイプの製品で、トランスフェクション試薬Xfect Transfection Reagentと、SARS-CoV-2スパイクタンパク質を発現するパッケージングプラスミドが1本のチューブ内にプレミックスされています。レンチウイルスベクタープラスミド溶液を添加して静置後、10 cmディッシュ中のLenti-X 293T Cell Line(製品コード 632180)に添加するだけで、高タイターのSARS-CoV-2シュードウイルスを作製することができます。
シュードウイルスの宿主細胞への遺伝子導入効率は、ベクタープラスミドに組み込まれているレポーター(ZsGreen1もしくはルシフェラーゼ)で検証可能です。
宿主細胞にはHuman ACE2 293T Cell Line(製品コード 631289)などが利用できます。
プレミックスタイプのLenti-X SARS-CoV-2 Packaging Single Shotsは、シュードウイルスにコートさせるSARS-CoV-2スパイクタンパク質を、以下の2種類から選択可能です。
- 野生型(全長):WT Spike, Full Length
SARS-CoV-2の武漢-Hu-1分離株(NC_045512.2)由来。哺乳類細胞での発現のためにコドンを最適化しています。 - 野生型(Truncated) :WT Spike, Truncated
単品のPackaging Mixは、上記2種類に加えて以下の4種類からも選択可能です。
- D614G変異型(全長):D614G Spike, Full Length
この変異型スパイクタンパク質を持つウイルスは、2020年に世界中に急速に広まりました。(Isabel et al.2020) - B.1.351変異型(全長):B.1.351 Spike, Full Length
南アフリカで最初に特定された変異型。WHOではβ型とされています。 - D614G変異型(Truncated) :D614G Spike, Truncated
- B.1.351変異型(Truncated) : B.1.351 Spike, Truncated
それぞれの全長配列に対してC末端の19アミノ酸を欠失させた変異体。 エンベロープ上のスパイクタンパク質の増加、さらにウイルスの感染力上昇に関連していることが報告されています。(Johnson et al.2020)
(注)
- 本システムでパッケージングを行う際は、必ずテトラサイクリン様活性を有しないTet System Approved FBSを含んだ培地で細胞培養してください。
- 本システムに細胞は含まれておりません。パッケージングには、別途、Lenti-X 293T Cell Line(製品コード 632180)をお求めください。
- 「研究開発等に係る遺伝子組換え生物等の第二種使用等に当たって執るべき拡散防止措置等を定める省令の規定に基づき認定宿主ベクター系等を定める件」(令和3年2月15日施行)が改正され、新型コロナウイルス(SARS-CoV-2)は実験分類をクラス3として追加されました。研究開発等に係る遺伝子組換え生物等に関する文部科学省・環境省令および各施設の遺伝子組換え実験に関する規則に従ってご使用ください。
- 特定の実験の場合は、シュードウイルスを濃縮する必要があります。実験に必要な濃縮倍率はシュードウイルスの種類によって異なります。詳しくは表1をご覧ください。
表1. 標的細胞の少なくとも50%を形質転換させるために必要なシュードウイルスの濃縮倍率(ZsGreen1をレポーターとして用いる場合)
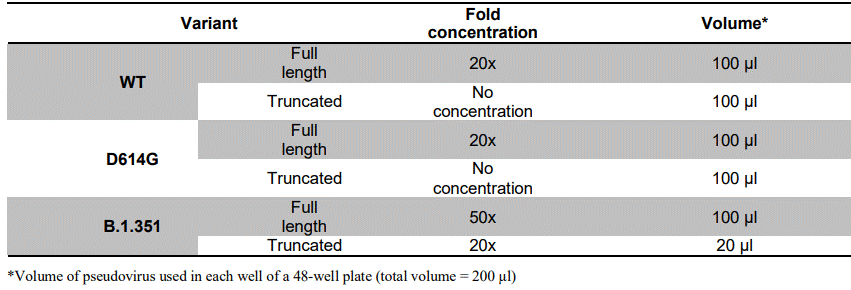
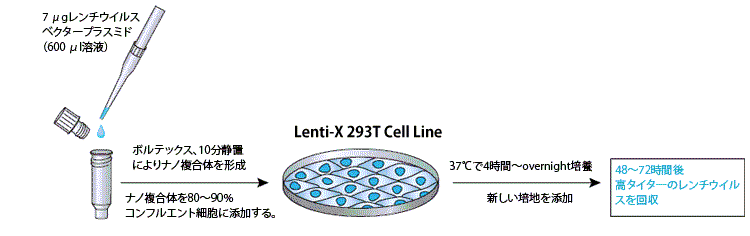
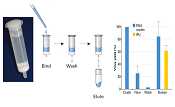
図1.Lenti-X SARS-CoV-2 Packaging Single Shotsのワークフロー
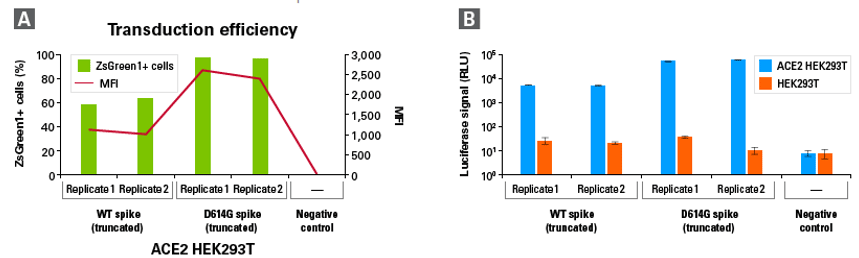
図2.SARS-CoV-2シュードウイルスによるヒトACE2陽性細胞株への遺伝子導入
Lenti-X SARS-CoV-2 Packaging Single Shots (WT Spike, Truncated)およびLenti-X SARS-CoV-2 Packaging Single Shots (D614G Spike, Truncated(終売))を使用し、プロトコールに従いSARS-CoV-2シュードウイルスを産生した。
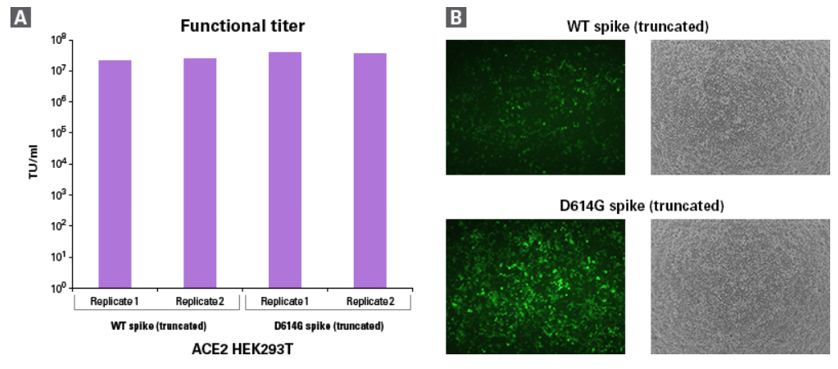
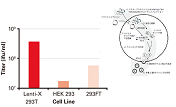
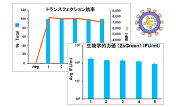
図3.SARS-CoV-2シュードウイルスの機能性タイター
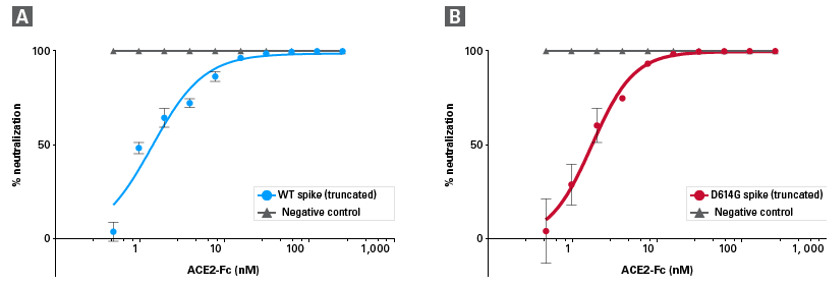
図4.SARS-CoV-2シュードウイルスに対するACE2-Fc融合タンパク質の中和活性
ACE2とIgGのFc部分を融合させたACE2-Fc融合タンパク質の段階希釈液を、SARS-CoV-2シュードウイルスとともに6 μg/mlポリブレン存在下でACE2陽性HEK293T細胞に添加した。
ACE2-Fc融合タンパク質はシュードウイルスのSARS-CoV-2スパイクタンパク質に結合することで、細胞へのウイルス感染を阻止する。
ウイルス感染の指標として、感染72時間後にルシフェラーゼ活性を測定した。
シュードウイルスのみを添加したコントロールに対する中和率としてグラフ化している(値は3回の試験の平均±SDで記載)。
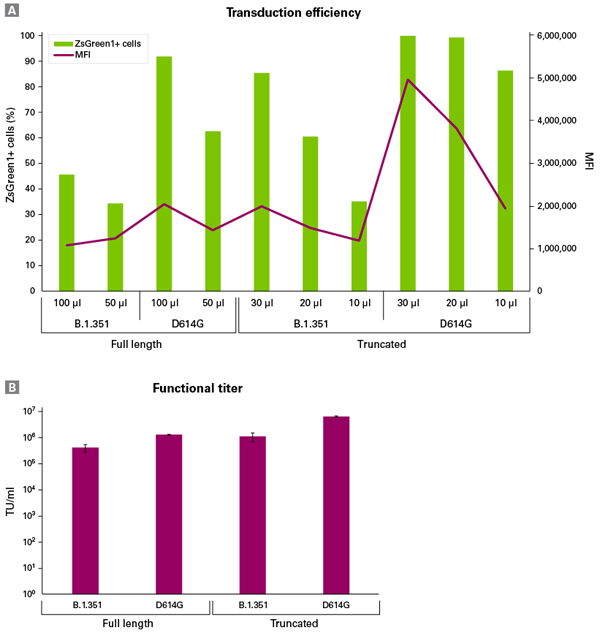
図5.D614G変異型およびB.1.351変異型シュードウイルスによるACE2陽性細胞株への遺伝子導入
Lenti-X SARS-CoV-2 Packaging Single Shots(D614G Spike, Full LengthまたはTruncated(終売)) およびLenti-X SARS-CoV-2 Packaging Single Shots (B.1.351 Spike, Full LengthまたはTruncated(終売))を使用し、プロトコールに従いZsGreen1を発現するSARS-CoV-2シュードウイルスを産生した。Lenti-X Concentrator(製品コード 631231)の標準プロトコールを用いて濃縮した各ウイルス粒子*を用いて、48-well plate内、 6 μg/mlポリブレン存在下でヒトACE2陽性HEK293T細胞株への遺伝子導入を行った。
*各ウイルス粒子の濃縮倍率および使用量
B.1.351 Full length:50倍濃縮/50 μl、100 μl
D614G Full length:20倍濃縮/50 μl、100 μl
B.1.351 Truncated:20倍濃縮/10 μl、20 μl、30 μl
D614G Truncated:20倍濃縮/10 μl、20 μl、30 μl
A : 遺伝子導入6日後に、フローサイトメトリーにより測定した導入効率
B : フローサイトメトリー解析から得られたSARS-CoV-2シュードウイルスの機能性タイター
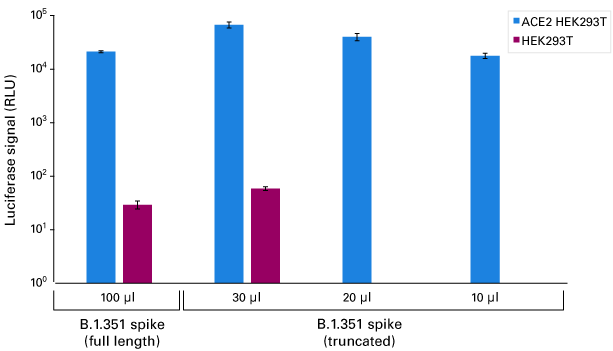
図6.B.1.351変異型シュードウイルスによるHEK293T細胞へのホタルルシフェラーゼ遺伝子導入
Lenti-X SARS-CoV-2 Packaging Single Shots (B.1.351 Spike, Full LengthまたはTruncated(終売))を使用し、プロトコールに従いホタルルシフェラーゼを発現するSARS-CoV-2シュードウイルスを産生した。Lenti-X Concentrator(製品コード 631231)の標準プロトコールを用いて20倍に濃縮したウイルス粒子(Full Lengthは100 μl、Truncatedは10~30 μl)を使用して 48-well plate内、 6 μg/mlポリブレン存在下でヒトACE2陽性HEK293T細胞株およびACE2陰性HEK293T細胞株(ルシフェラーゼ活性のバックグラウンド確認のため)への遺伝子導入を行った。遺伝子導入3日後に、ルシフェラーゼ活性を測定した。


図1.Lenti-X SARS-CoV-2 Packaging Single Shotsのワークフロー

図2.SARS-CoV-2シュードウイルスによるヒトACE2陽性細胞株への遺伝子導入
Lenti-X SARS-CoV-2 Packaging Single Shots (WT Spike, Truncated)およびLenti-X SARS-CoV-2 Packaging Single Shots (D614G Spike, Truncated(終売))を使用し、プロトコールに従いSARS-CoV-2シュードウイルスを産生した。
A:ZsGreen1を発現するSARS-CoV-2シュードウイルス100 μlを用いて、48-well plate内、6 μg/mlポリブレン存在下でヒトACE2陽性HEK293T細胞株への遺伝子導入を行った。遺伝子導入6日後に、フローサイトメトリーによって導入効率を測定した。
B:ホタルルシフェラーゼを発現するSARS-CoV-2シュードウイルスを用いて、ACE2陽性HEK293T細胞株、および6 μg/mlポリブレン存在下でACE2陰性HEK293T細胞株(ルシフェラーゼ活性のバックグラウンド確認のため)への遺伝子導入を行った。遺伝子導入6日後に、ルシフェラーゼ活性を測定した。

図3.SARS-CoV-2シュードウイルスの機能性タイター
A:図2AのZsGreen1発現のフローサイトメトリー解析から得られたSARS-CoV-2シュードウイルスの機能性タイター
B:感染72時間後のACE2陽性HEK293T細胞の顕微鏡画像

図4.SARS-CoV-2シュードウイルスに対するACE2-Fc融合タンパク質の中和活性
ACE2とIgGのFc部分を融合させたACE2-Fc融合タンパク質の段階希釈液を、SARS-CoV-2シュードウイルスとともに6 μg/mlポリブレン存在下でACE2陽性HEK293T細胞に添加した。
ACE2-Fc融合タンパク質はシュードウイルスのSARS-CoV-2スパイクタンパク質に結合することで、細胞へのウイルス感染を阻止する。
ウイルス感染の指標として、感染72時間後にルシフェラーゼ活性を測定した。
シュードウイルスのみを添加したコントロールに対する中和率としてグラフ化している(値は3回の試験の平均±SDで記載)。

図5.D614G変異型およびB.1.351変異型シュードウイルスによるACE2陽性細胞株への遺伝子導入
Lenti-X SARS-CoV-2 Packaging Single Shots(D614G Spike, Full LengthまたはTruncated(終売)) およびLenti-X SARS-CoV-2 Packaging Single Shots (B.1.351 Spike, Full LengthまたはTruncated(終売))を使用し、プロトコールに従いZsGreen1を発現するSARS-CoV-2シュードウイルスを産生した。Lenti-X Concentrator(製品コード 631231)の標準プロトコールを用いて濃縮した各ウイルス粒子*を用いて、48-well plate内、 6 μg/mlポリブレン存在下でヒトACE2陽性HEK293T細胞株への遺伝子導入を行った。
*各ウイルス粒子の濃縮倍率および使用量
B.1.351 Full length:50倍濃縮/50 μl、100 μl
D614G Full length:20倍濃縮/50 μl、100 μl
B.1.351 Truncated:20倍濃縮/10 μl、20 μl、30 μl
D614G Truncated:20倍濃縮/10 μl、20 μl、30 μl
A : 遺伝子導入6日後に、フローサイトメトリーにより測定した導入効率
B : フローサイトメトリー解析から得られたSARS-CoV-2シュードウイルスの機能性タイター

図6.B.1.351変異型シュードウイルスによるHEK293T細胞へのホタルルシフェラーゼ遺伝子導入
Lenti-X SARS-CoV-2 Packaging Single Shots (B.1.351 Spike, Full LengthまたはTruncated(終売))を使用し、プロトコールに従いホタルルシフェラーゼを発現するSARS-CoV-2シュードウイルスを産生した。Lenti-X Concentrator(製品コード 631231)の標準プロトコールを用いて20倍に濃縮したウイルス粒子(Full Lengthは100 μl、Truncatedは10~30 μl)を使用して 48-well plate内、 6 μg/mlポリブレン存在下でヒトACE2陽性HEK293T細胞株およびACE2陰性HEK293T細胞株(ルシフェラーゼ活性のバックグラウンド確認のため)への遺伝子導入を行った。遺伝子導入3日後に、ルシフェラーゼ活性を測定した。
内容
- Lenti-X SARS-CoV-2 Packaging Single Shots (WT Spike, Full Length)(製品コード 632668)
- Lenti-X SARS-CoV-2 Packaging Mix (WT Spike, Full Length) (製品コード 632672)
Lenti-X SARS-CoV-2 Packaging Mix(No-Envelope Control) (製品コード 632676)
Lenti-X Reporter Vector Set* - Lenti-X SARS-CoV-2 Packaging Single Shots (WT Spike, Truncated)(製品コード 632670)
- Lenti-X SARS-CoV-2 Packaging Mix (WT Spike, Truncated) (製品コード 632674)
Lenti-X SARS-CoV-2 Packaging Mix (No-Envelope Control) (製品コード 632676)
Lenti-X Reporter Vector Set* - Lenti-X SARS-CoV-2 Packaging Mix (WT Spike, Full Length) (製品コード 632672)
- Lenti-X SARS-CoV-2 Packaging Mix (D614G Spike, Full Length) (製品コード 632673)
- Lenti-X SARS-CoV-2 Packaging Mix (B.1.351 Spike, Full Length) (製品コード 631290)
- Lenti-X SARS-CoV-2 Packaging Mix (WT Spike, Truncated) (製品コード 632674)
- Lenti-X SARS-CoV-2 Packaging Mix (D614G Spike, Truncated) (製品コード 632675)
- Lenti-X SARS-CoV-2 Packaging Mix (B.1.351 Spike, Truncated) (製品コード 631291)
- 各12チューブ(凍結乾燥品)
※1チューブで10 cmディッシュ1枚のパッケージングに使用可能 - Lenti-X SARS-CoV-2 Packaging Mix (No-Envelope Control) (製品コード 632676)
- 6チューブ(凍結乾燥品)
※1チューブで10 cmディッシュ1枚のパッケージングに使用可能
* Lenti-X Reporter Vector Set
pLVXS-ZsGreen1-Puro Vector(500 ng/μl) 20 μl
pLVXS-Luciferase-Puro Vector(500 ng/μl) 20 μl
本セット単独での販売はありません。
不足分は大腸菌で増やしてお使いください。
pLVXS-ZsGreen1-Puro Vector(500 ng/μl) 20 μl
pLVXS-Luciferase-Puro Vector(500 ng/μl) 20 μl
本セット単独での販売はありません。
不足分は大腸菌で増やしてお使いください。
ベクターマップ
保存
-20℃
(各 Lenti-X SARS-CoV-2 Packaging Mixは乾燥剤が入った付属のホイルポーチ内で保管)
(各 Lenti-X SARS-CoV-2 Packaging Mixは乾燥剤が入った付属のホイルポーチ内で保管)
本製品以外に必要な試薬等
- Lenti-X 293T Cell Line(製品コード 632180)
- Lenti-X GoStix Plus(製品コード 631280/631281)
- Human ACE2 293T Cell Line(製品コード 631289)
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。