製品説明
Human Cell-Free Protein Expression Master Mix for mRNAは、mRNAを用いた無細胞タンパク質合成のための試薬です。本試薬には、ヒト細胞由来のリボソーム、翻訳開始および伸長因子、tRNAなど、タンパク質翻訳に必要なすべての成分が含まれています。単一のチューブ内において本試薬にタンパク質をコードするcapped mRNA*1を添加し、32℃で数時間インキュベートするだけの簡単な手順でタンパク質合成を行うことが可能です。本製品は、従来の細胞ベースの実験と比較して、目的タンパク質の生産だけでなく、mRNA構築物の評価にも迅速な手段となります。したがって、ワクチン開発などの用途向けに設計されたmRNA構築物のスクリーニングに適しています。*2
*1 タンパク質発現にはmRNAにcap構造を付加する必要があります。一般的には、capアナログを使用した共転写キャッピングや、Vaccinia virusまたはFaustovirus由来のキャッピング酵素および2’-O-Methyltransferaseを使用した酵素的キャッピングが使用されます。
*2 評価する検体数が多い場合は、同一ロットでの試験をおすすめします。また、指標となるコントロールを設定し、試験間の発現レベルを確認することを推奨します。
*1 タンパク質発現にはmRNAにcap構造を付加する必要があります。一般的には、capアナログを使用した共転写キャッピングや、Vaccinia virusまたはFaustovirus由来のキャッピング酵素および2’-O-Methyltransferaseを使用した酵素的キャッピングが使用されます。
*2 評価する検体数が多い場合は、同一ロットでの試験をおすすめします。また、指標となるコントロールを設定し、試験間の発現レベルを確認することを推奨します。
図1‐A
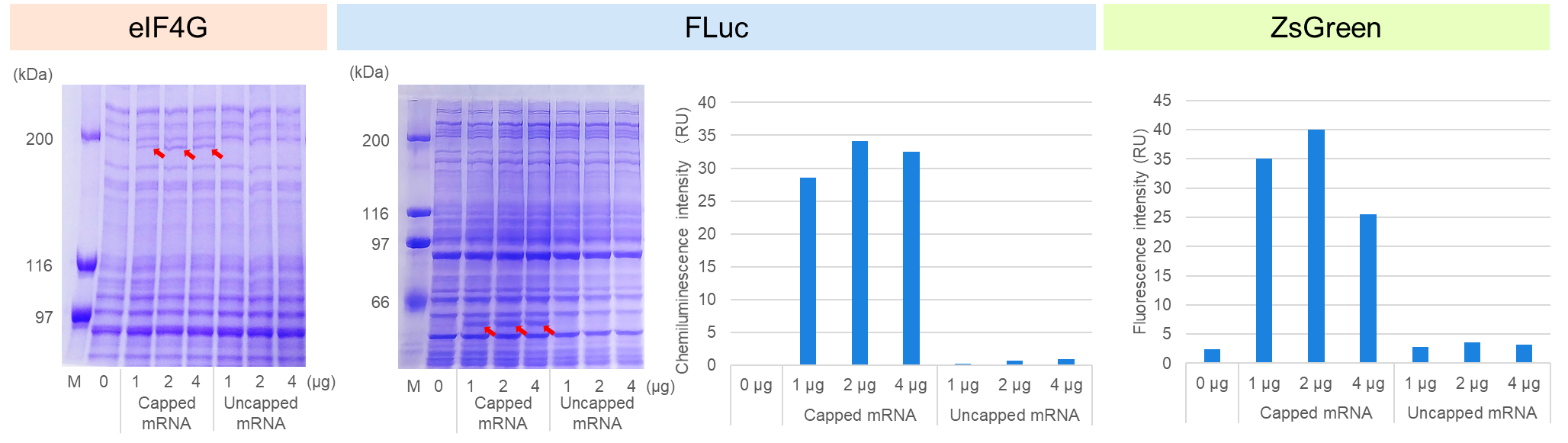
A.異なるmRNA添加量におけるタンパク質の発現
Human Cell-Free Protein Expression Master Mix for mRNAに、3種類のキャップ化*3および非キャップ化mRNAをそれぞれ1、2、4 μg添加し、32℃で3時間インキュベートした。その結果、キャップ化mRNAの添加においてのみSDS-PAGE(eIF4G、FLuc(赤矢印))、化学発光測定(FLuc)、または蛍光測定(ZsGreen)により目的タンパク質の高い発現が確認された。このことは、本無細胞発現系において、mRNAの発現がキャップ依存的であることを示している。また、いずれのタンパク質も2 μgのmRNA添加によって発現が最大化されることが示唆された。
図1-B
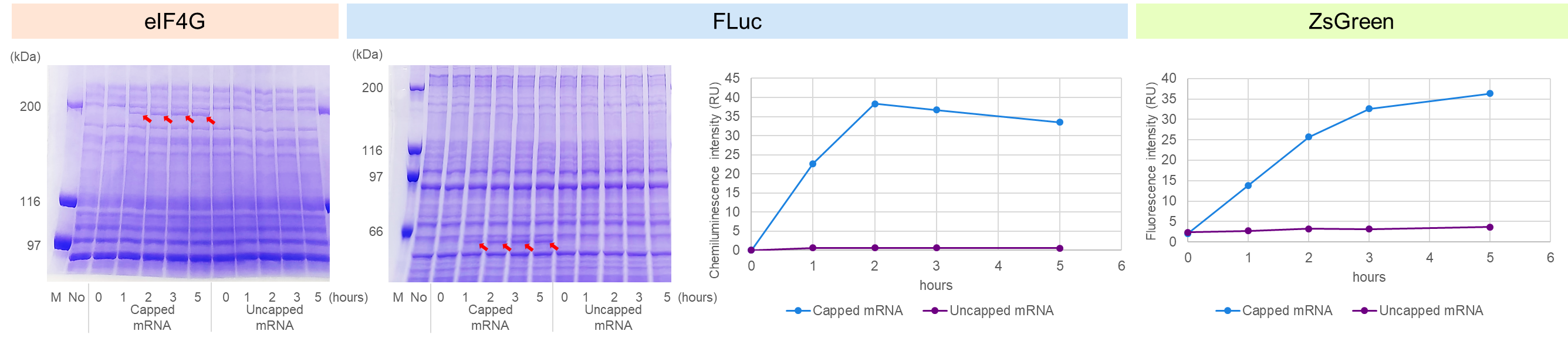
B.異なる反応時間におけるタンパク質の発現
3種類のキャップ化*3および非キャップ化mRNAをそれぞれ2 μg添加し、32℃で0、1、2、3、および5時間インキュベートした。その結果、キャップ化mRNAの添加においてのみ目的タンパク質の高い発現が確認され、eIF4Gでは3~5時間、FLucでは2時間、ZsGreenでは5時間でタンパク質の発現が最大化された。このことは、本無細胞発現系において、最適な反応時間がタンパク質によって異なることを示唆している。
図1-C
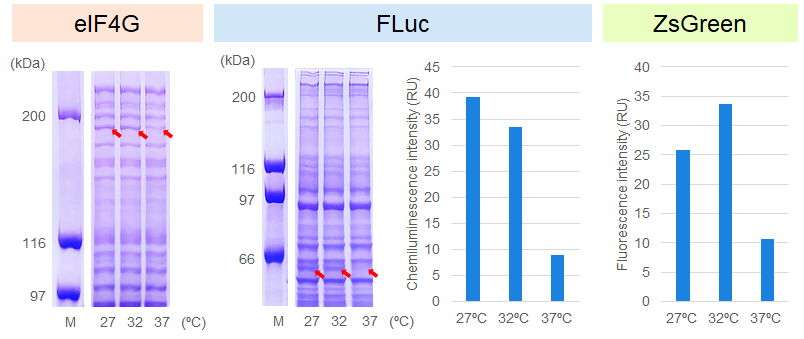
C.異なる反応温度におけるタンパク質の発現
3種類のキャップ化mRNA*3をそれぞれ2 μg添加し、27℃、32℃、および37℃で3時間インキュベートした。その結果、eIF4Gは27℃または32℃、FLucは27℃、ZsGreenは32℃でタンパク質の発現が最大化された。このことは、本無細胞発現系において、最適な反応温度がタンパク質によって異なることを示唆している。
*3 Cloning Kit for mRNA Template (BspQ I) (製品コード 6133)、Takara IVTpro T7 mRNA Synthesis Kit (製品コード 6144)、およびCleanCap Reagent AG (3’OMe) (TriLink社) を用いました。
図1.mRNA添加による分子量の異なる3種類のタンパク質の無細胞発現検討(elF4G: 170 kDa, FLuc: 61 kDa, ZsGreen: 26 kDa)
図2-A

A. 異なる3’ UTR配列を持つFLuc mRNAの準備
ヒトのα-globin、β-globin、AES遺伝子由来の3’ UTR配列、および肝炎ウイルス由来のWPRE(Woodchuck hepatitis virus Posttranscriptional Regulatory Element)配列のいずれかをFLuc(Firefly Luciferase)遺伝子の下流に挿入したmRNA用の鋳型DNAを用意した。5’ UTR、FLuc、およびPoly(A)配列は、共通の配列を使用した。これらのDNA配列を鋳型として、Takara IVTpro T7 mRNA Synthesis Kit(製品コード 6144)およびCleanCap AG(3’ OMe)(TriLink社)を使用して、各キャップ化mRNAを準備した。
図2-B
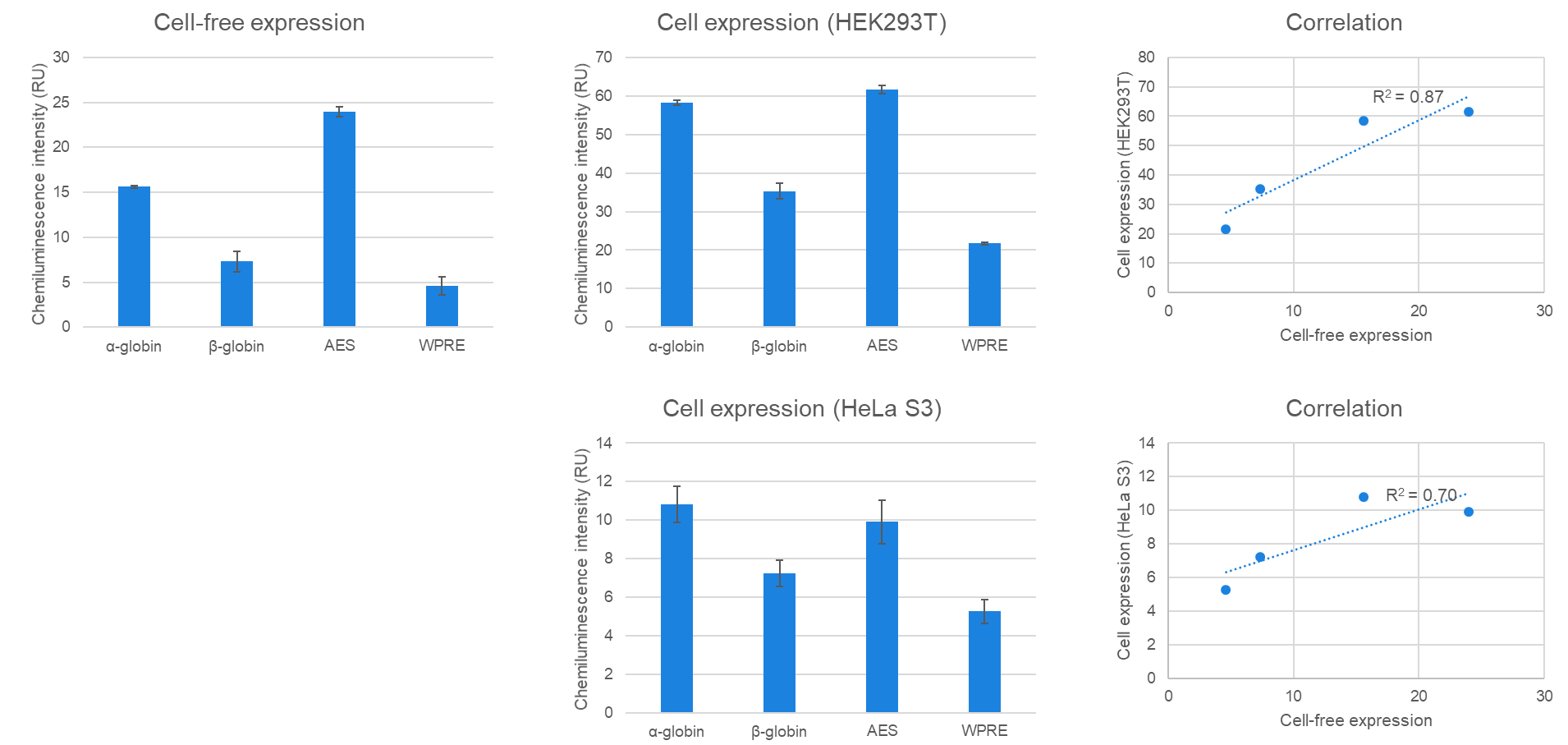
B.FLucタンパク質の無細胞発現と細胞発現
Human Cell-Free Protein Expression Master Mix for mRNAに各キャップ化FLuc mRNAを2 μg添加し、27℃で2時間インキュベートした。一方、同mRNAをHEK293T細胞およびHeLa S3細胞にTransIT-mRNA Transfection Reagent(製品コード MIR2225)を用いて0.5 μgトランスフェクションし、24時間培養した。これらの反応後、サンプルの一部を用いてFLucタンパク質の活性を化学発光測定した。その結果、無細胞発現系と細胞発現系の比較において、FLucタンパク質の発現(活性)レベルに高い相関が見られた(HEK293T: R2=0.87、HeLa S3: R2=0.70)。このことは、mRNAを使用した無細胞発現系が、mRNA構築物の評価やスクリーニングにとって簡便かつ迅速な手段となり得ることを示唆している。
図2.無細胞発現と細胞発現の相関
内容
Human Cell-Free Protein Expression Master Mix for mRNA 180 μl
保存
-80℃
※本製品は受領後、直ちに-80℃で保管してください。-80℃より高い温度で保管すると性能が低下する場合があります。
※一度に使い切らない場合は、凍結融解による性能低下を避けるため、最初の融解時に小分け分注して保存することをお勧めします。
※本製品は受領後、直ちに-80℃で保管してください。-80℃より高い温度で保管すると性能が低下する場合があります。
※一度に使い切らない場合は、凍結融解による性能低下を避けるため、最初の融解時に小分け分注して保存することをお勧めします。
用途
- 設計したmRNA構築物のスクリーニング
- 毒性のあるタンパク質の無細胞合成
操作
| Human Cell-Free Protein Expression Master Mix for mRNA | 18 μl | |
| Capped mRNA | 2 μg | *4 |
| Nuclease-free water | X μl | |
| Total | 20 μl |
- Human Cell-Free Protein Expression Master Mix for mRNAを氷上で融解し、穏やかにピペッティングしてよく混合した後、0.2 mlチューブに18 μlを分注する。
- 1.を32℃で5分間プレインキュベーションする。
- 2.にCapped mRNA 2 μg*4と必要に応じてNuclease-free waterを加えて、Total 20 μlの反応液を調製する。
- 反応液を穏やかにピペッティングしてよく混合した後、27~32℃で1~5時間*5インキュベーションする。
*4 Capped mRNA量は2 μgを推奨します。目的タンパク質の産生が少ない場合は、添加量を変更してお試しください。
*5 最適な反応温度と反応時間は目的タンパク質やmRNA構築物によって異なりますが、初回検討時は32℃で3時間の反応を推奨します。
この製品を見た人は、
こんな製品も見ています
-

mRNA合成(in vitro Transcription)製品ガイド
-

RNase T1, AOF
プロセス開発や医薬品の原料製造に
-
Human Cell-Free Protein Expression System
簡便で高効率!無細胞タンパク質合成
-

PrimeCap™ T7 RNA Polymerase (low dsRNA) GMP grade
dsRNAの大幅な低減と高いキャッピング効率を実現するT7 RNA Polymerase改変体【GMP grade製品】
-
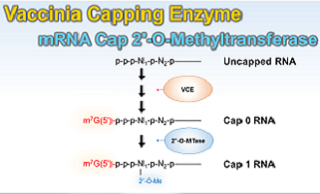
Vaccinia Capping Enzyme
RNAの5’末端にm7G cap構造(Cap 0)を付加する酵素
-
Takara IVTpro™ mRNA Synthesis System
in vitro転写による高品質、高収量なCleanCap修飾mRNA合成キット
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。


.png)