製品説明
mRNA Cap 2’-O-Methyltransferase(2’-O-MTase)は、vacciniaウイルス由来のメチル化酵素であり、5’末端に7-methylguanylate cap (m7G cap) 構造(Cap 0)を持つRNAの1番目のヌクレオチドの2’-O部位を特異的にメチル化し、Cap 1構造を付与します。Cap 1構造を持つRNAは、生体内において自然免疫応答を回避するのに役立ち、翻訳を促進することが知られています。本製品には反応バッファーとメチル基供与体としてのS-adenosylmethionine (SAM)が含まれており、高効率にCap-0 RNAからCap-1 RNAを調製できます。
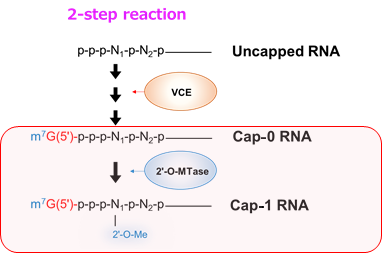
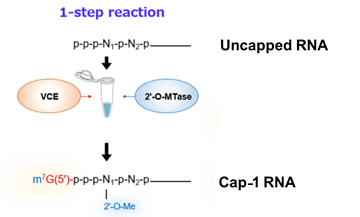
また、本酵素をVaccinia Capping Enzyme(製品コード 2460A/B)と同時に用いることで、キャップ化されていないRNA(5’-triphosphate RNA)からCap 1構造を持つRNAを直接シングルステップ反応で調製することもできます(使用例-2をご参照ください)。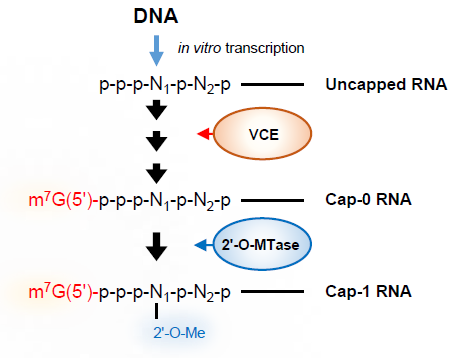
また、本酵素をVaccinia Capping Enzyme(製品コード 2460A/B)と同時に用いることで、キャップ化されていないRNA(5’-triphosphate RNA)からCap 1構造を持つRNAを直接シングルステップ反応で調製することもできます(使用例-2をご参照ください)。

用途
- Vaccinia Capping Enzyme(VCE)などでm7G cap構造(Cap 0)を付与したRNAのCap 1構造への変換
- シングルステップでのRNA(5’-triphosphate RNA)へのCap 1構造付与(※VCEの併用が必要)
- in vitro transcription(IVT)などで合成したm7G cap構造(Cap 0)を持つRNAのCap 1構造への変換
- mRNAのin vivo投与に際しての翻訳効率促進、および免疫原性の低下(自然免疫応答回避)
内容
| mRNA Cap 2’-O-Methyltransferase (50 U/μl) | 2,500 U |
| 10× Capping Buffer | 100 μl |
| S-adenosylmethionine (SAM) (32 mM) | 100 μl |
保存
-20℃
濃度
50 U/μl
起源
Escherichia coli carrying a plasmid containing the gene for vaccinia virus mRNA cap 2’-O-methyltransferase
一般的性質
質量:約40 kDa
活性の定義
37℃において1時間に10 pmolのCap-0 RNAをメチル化する酵素量を1 Uとする。
活性測定用反応液組成
| 1× | Capping Buffer | |
| 1 mM | DTT | |
| 13.75 μCi/ml | [3H]SAM | |
| 2 μg/50 μl | 100 nt Cap-0 RNA |
品質管理データ
性能試験結果については、各ロットのCertificate of Analysis(CoA)をご覧ください。CoAはhttps://catalog.takara-bio.co.jp/search/doc_index.phpからダウンロードできます。
注意事項
- 本酵素の激しい攪拌は行わないでください。
- 鋳型となるRNAや試薬、反応に使用するチューブ、マイクロピペット用チップなどにRNaseが混入した場合、反応後に得られるRNAの収量が低下したり、RNAが断片化します。反応に使用するチューブ、マイクロピペット用チップは専用のものとし、反応を行うときはディスポーザブル手袋を着用して、RNaseが混入しないように注意してください。
使用例
<使用例-1(Cap-0 RNAからCap-1 RNAの調製)>

37℃で1時間インキュベーションする。*4
| Denatured Cap-0 RNA (10 μg)*1、4 | 16 μl | |
| 10× Capping Buffer | 2 μl | |
| SAM (4 mM, dilute 32 mM stock to 4 mM)*2 | 1 μl | |
| mRNA Cap 2’-O-Methyltransferase (50 U/μl) | 1 μl | |
| Total | 20 μl | *3 |
37℃で1時間インキュベーションする。*4
<使用例-2(Uncapped RNA(5’-triphosphate RNA)からCap-1 RNAの調製)>

37℃で1時間インキュベーションする。*4
| Denatured RNA transcripts (10 μg)*1、4 | 14 μl | |
| 10× Capping Buffer | 2 μl | |
| GTP (10 mM) | 1 μl | |
| SAM (4 mM, dilute 32 mM stock to 4 mM)*2 | 1 μl | |
| Vaccinia Capping Enzyme (10 U/μl) | 1 μl | |
| mRNA Cap 2’-O-Methyltransferase (50 U/μl) | 1 μl | |
| Total | 20 μl | *3 |
37℃で1時間インキュベーションする。*4
| *1 | 使用するRNAは5’末端が複雑な2次構造を取る場合に備え、反応前に熱変性する。 <熱変性>
|
||||
| *2 | SAMは不安定であるため、反応前に必要分を32 mMのストック溶液からRNase-free waterで希釈調製する。希釈液は反応まで氷上で保存する。 | ||||
| *3 | 必要に応じてスケールアップ可能。 | ||||
| *4 | RNAの長さが200 nt以下である場合は、メチル化効率(およびcap付加効率)を上げるため反応時間を延長する(1時間→2時間)。 |
| 注: | 反応液中のRNAを安定的に保つため、RNase inhibitorが使用できます。使用する場合は、最終濃度が1 U/μlとなるように添加してください。 |
Protocols
VCEと2’-O-MTaseを用いたRNAの5’-Cap修飾(Cap-0 / Cap-1 RNA調製)
1-step反応系と2-step反応系:目的に応じたRNAの5’-Cap修飾方法の使い分け
Application
mRNA合成(in vitro Transcription)製品ガイド
カスタム製造・OEM
使用文献・参考文献
関連製品・受託
mRNA Cap 2'-O-Methyltransferase, HQ
Takara IVTpro™ mRNA Synthesis System
Faustovirus Capping Enzyme (S17)
Vaccinia Capping Enzyme
Recombinant RNase Inhibitor ver.2.0
PrimeCap® T7 RNA Polymerase (low dsRNA)
T7 RNA Polymerase ver.2.0
SP6 RNA Polymerase
Ribonucleoside 5'-Triphosphates
RNase-free Water
NucleoSpin® RNA Clean-up
TransIT®-mRNA Transfection Reagent
この製品を見た人は、
こんな製品も見ています
-

mRNA合成(in vitro Transcription)製品ガイド
-
Takara IVTpro™ mRNA Synthesis System
in vitro転写による高品質、高収量なCleanCap修飾mRNA合成キット
-
Recombinant RNase Inhibitor ver.2.0
酸化耐性を強化したバージョンアップ品
-
Faustovirus Capping Enzyme (S17)
従来酵素に比べ幅広い温度帯で反応可能なm7G cap構造(Cap 0)付加酵素
-
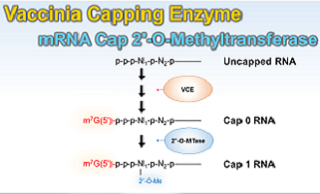
Vaccinia Capping Enzyme
RNAの5’末端にm7G cap構造(Cap 0)を付加する酵素
-

mRNA Cap 2'-O-Methyltransferase, HQ
m7G capped RNA(Cap-0)をCap-1構造に変換するメチル基転移酵素(High Quality grade)
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。


.png)