※色文字での表示は、キャンペーン価格およびそのキャンペーン期間です。
※Capアナログは本製品に含まれていません。CleanCap Reagent AG(TriLink社)などを別途ご用意ください。
※Capアナログは本製品に含まれていません。CleanCap Reagent AG(TriLink社)などを別途ご用意ください。
カートにいれる
WEB会員ログインが必要です
製品説明
PrimeCap T7 RNA Polymeraseは、Capアナログ依存的RNA合成、低dsRNA(double-strand RNA)生成、および耐熱性(~52℃)の特長を併せ持つ、T7 RNA polymerase*1の改変体です。本酵素とCleanCap Reagent AG(TriLink社)などのCapアナログを組み合わせてin vitro transcription(IVT)を行うことで、免疫原性のあるdsRNAの生成を大幅に低減しつつ、高いキャッピング効率とmRNAの高収量を実現します。高品質なmRNAを大量に調製することが可能なため、本製品はワクチンなどのRNA医薬分野での研究開発に適しています。
*1 T7 promoter配列を含む二本鎖DNAを鋳型、NTPを基質として、プロモーター下流の領域を転写し、in vitroで一本鎖RNAを合成する酵素
代表的なT7 promoter配列と転写開始点(CleanCap Reagent AGを使用する場合の注意点)
*1 T7 promoter配列を含む二本鎖DNAを鋳型、NTPを基質として、プロモーター下流の領域を転写し、in vitroで一本鎖RNAを合成する酵素
代表的なT7 promoter配列と転写開始点(CleanCap Reagent AGを使用する場合の注意点)
IVT反応の鋳型DNAを調製する際の代表的なT7 promoter配列を下記に示します。合成するRNA配列や5ʹ-cap修飾に使用するCapアナログの特徴に応じて鋳型をデザインする必要がありますので、目的に合わせて鋳型DNAをご準備ください。

【CleanCap Reagent AGを利用する場合】
転写開始点(+1 position)からのNGG配列は、AGGとする必要があります。
【Capアナログを使用しない場合】
転写開始点(+1position)からのNGG配列は、AGGまたはGGGとします。
【ARCAを利用する場合】
転写開始点(+1position)からのNGG配列は、GGGとする必要があります。
転写開始点(+1 position)からのNGG配列は、AGGとする必要があります。
【Capアナログを使用しない場合】
転写開始点(+1position)からのNGG配列は、AGGまたはGGGとします。
【ARCAを利用する場合】
転写開始点(+1position)からのNGG配列は、GGGとする必要があります。

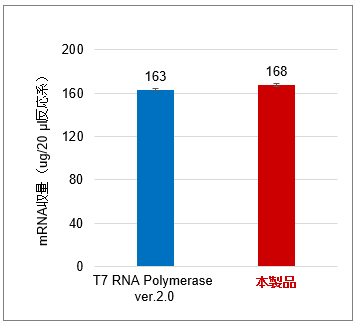
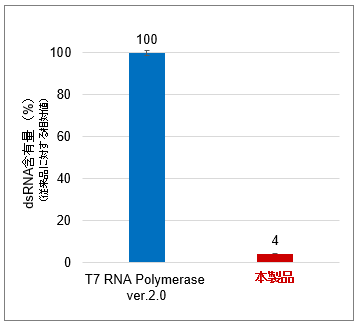
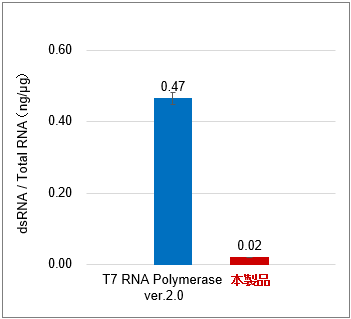
図1.FLuc mRNA(約1.9 kb)を合成した際の収量(左図)、dsRNAの生成抑制効果(中央図)およびdsRNA含有量(右図)
Positive Control Template (FLuc)(Takara IVTpro T7 mRNA Synthesis Kit(製品コード 6144)の構成品)を鋳型として、T7 RNA Polymerase ver.2.0(製品コード 2541A)と本製品を用いて、CleanCap Reagent AG使用時の標準的な20 μl反応系(※使用例を参照)37℃でのIVT反応結果を比較したところ、mRNA合成収量を損なうことなく、dsRNAの生成を10%以下に抑えられることを確認した。
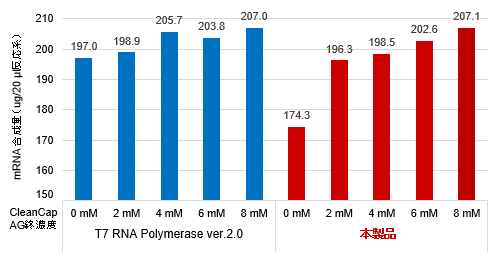
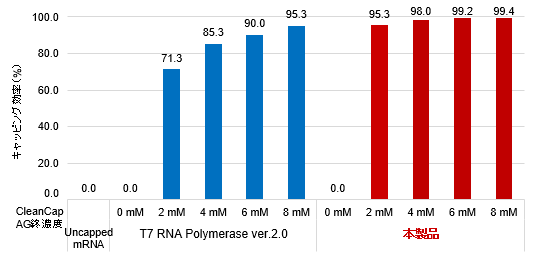
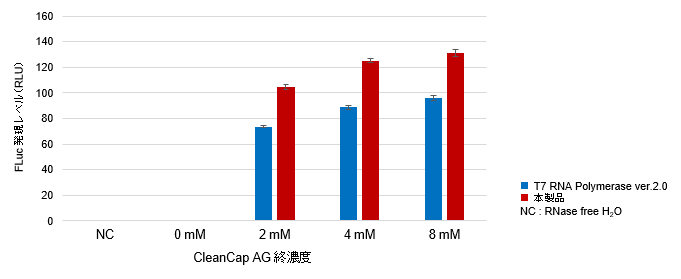
図2. Capアナログ濃度の違いによるmRNA収量(左上図)、キャッピング効率(右上図)およびタンパク質発現レベル(左下図)の比較
Positive Control Template (FLuc)を鋳型として、本製品またはT7 RNA Polymerase ver.2.0(製品コード 2541A)と異なる濃度のCleanCap Reagent AG(TriLink社)(0、2、4、6、8 mM)を使用したIVT反応によりFLuc mRNA(約1.9 kb)を合成し、収量を測定した。また、合成されたmRNAのキャッピング効率をLC/MSで測定した。さらに、合成されたFLuc mRNAをHEK293細胞にトランスフェクションし、細胞内でのタンパク質発現レベルをFLucアッセイにより評価した。
その結果、本製品はCleanCap Reagent AGの濃度依存的にmRNAの収量が増加し(左上図)、低濃度のCleanCap Reagent AGの使用でも高いキャッピング効率が確認できた(右上図)。また、どのCleanCap Reagent AG濃度においても、本製品で合成されたmRNAはタンパク質発現レベルが高いことが確認された(左下図)。
用途
- Capアナログを使用したcapped mRNAの合成(共転写キャッピング)
- 酵素的キャッピングに使用するuncapped RNAの合成(注:RNA収量はCapアナログ使用時と比べ、10~40%減少します。)
内容
| PrimeCap T7 RNA Polymerase (200 U/μl) | 20,000 U |
| 10×T7 RNA Polymerase Buffer | 1 ml |
保存
-20℃
濃度
200 U/μl
起源
Escherichia coli carrying a plasmid containing the gene for phage T7 RNA polymerase variant
一般的性質
質量:約99.8 kDa
補因子:Mg2+
補因子:Mg2+
活性の定義
37℃において1時間に1 nmolの[3H]GMPを酸不溶性沈殿物に取り込む酵素量を1 Uとする。
活性測定用反応液組成
| 40 mM | Tris-HCl(pH8.0) |
| 8 mM | MgCl2 |
| 2 mM | スペルミジン |
| 5 mM | DTT |
| 0.4 mM | ATP・UTP・CTP |
| 0.4 mM | [3H]GTP |
| 1 μg/50 μl | pT7-2 DNA |
品質管理データ
性能試験結果については、各ロットのCertificate of Analysis(CoA)をご覧ください。CoAはhttps://catalog.takara-bio.co.jp/search/doc_index.phpからダウンロードできます。
注意事項
- 本酵素の激しい攪拌は行わないでください。
- 鋳型となる二本鎖DNAや試薬、反応に使用するチューブ、マイクロピペット用チップなどにRNaseが混入した場合、反応後に得られるRNAの収量が低下したり、RNAが断片化します。反応に使用するチューブ、マイクロピペット用チップは専用のものとし、反応を行うときはディスポーザブル手袋を着用して、RNaseが混入しないように注意してください。
- 均一な長さのRNAを合成するために、T7 promoterを含む線状化したプラスミドあるいはPCR産物などが鋳型DNAとして使用できます。線状化鋳型の3’末端は5’突出あるいは平滑末端が望ましいとされています。必要に応じてBspQ I(製品コード 1227A/B)などの制限酵素をご利用ください。
- 10×T7 RNA Polymerase Buffer中にはスペルミジンが含まれています。スペルミジンは核酸と複合体を形成して、場合によっては不溶物質として沈殿する可能性がありますので、鋳型DNAは必ず酵素以外のコンポーネントの最後に加えるようにしてください。
- 本製品にはCapアナログやNTPs(ATP、CTP、GTP、UTP)は含まれていません。必要に応じてCleanCap Reagent AG(TriLink社)やRibonucleoside 5’-Triphosphatesなどを別途ご用意ください。
- IVTでのRNA合成反応を促進するPyrophosphatase (inorganic)(製品コード 2450A/B)や、反応中の分解を抑制するRecombinant RNase Inhibitor ver.2.0(製品コード 2315A/B)の併用を推奨します。詳細は各製品ページをご確認ください。
使用例
| RNase-free Water | X µl |
| 10×T7 RNA Polymerase Buffer | 2 µl |
| ATP、CTP、GTP、UTP*1 | 各 10 mM |
| CleanCap Reagent AG*2 | 4 mM |
| Template DNA | 0.5~2 µg |
| Recombinant RNase Inhibitor ver.2.0 | 20 U |
| Pyrophosphatase (inorganic) | 0.1 U |
| PrimeCap T7 RNA Polymerase | 200 U |
| Total | 20 µl |
*1 N1-Methyl-Pseudo-UTPなどの修飾NTPを使用する場合は、対応するNTPを等量で置き換えてください。
*2 CleanCap Reagent AG(TriLink社:Code. N-7113-1/5/10)
Application
IVT反応温度の違いによるmRNA収量、タンパク質発現レベル
さまざまなサイズ(1.0~12.3 kb)のmRNA合成(CleanCap使用・不使用)
電気泳動およびバイオアナライザーによるmRNA解析
mRNA合成(in vitro Transcription)製品ガイド
カスタム製造・OEM
関連製品・受託
PrimeCap® T7 RNA Polymerase (low dsRNA), HQ
Takara IVTpro™ mRNA Synthesis System (low dsRNA)
Takara IVTpro™ mRNA Synthesis System
T7 RNA Polymerase ver.2.0
T7 RNA Polymerase, HQ
Pyrophosphatase (inorganic)
Pyrophosphatase (inorganic), HQ
Recombinant RNase Inhibitor ver.2.0
Ribonucleoside 5'-Triphosphates
RNase-free Water
BspQ I
BspQ I, HQ
この製品を見た人は、
こんな製品も見ています
-

Takara IVTpro™ mRNA Synthesis System (low dsRNA)
dsRNAの生成を大幅に低減した高品質なmRNA合成キット
-
Takara IVTpro™ mRNA Synthesis System
in vitro転写による高品質、高収量なCleanCap修飾mRNA合成キット
-

PrimeCap® T7 RNA Polymerase (low dsRNA), HQ
dsRNAの生成を大幅に低減し、高品質mRNAを合成可能(High Quality grade)
-

Pyrophosphatase (inorganic)
RNAやDNAの合成反応を促進する酵素
-

T7 RNA Polymerase ver.2.0
反応性を飛躍的に高めたバージョンアップ品
-

mRNA合成(in vitro Transcription)製品ガイド
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。


.png)