製品説明
本製品は、AAVベクター作製に必要な3種の要素である、トランスファープラスミド(pAAV-ZsGreen1)、Rep/Capプラスミド(pRC1 or 2 or 5 or 6 or 8 or 9)、およびアデノウイルスヘルパープラスミド(pHelper)を1つに統合したプラスミドです。
ITR配列間に、CMVプロモーター制御下で発現するZsGreen1遺伝子が配置されており、このプラスミドを用いてAAVを作製することで、ZsGreen1を発現するAAVを効率よく作製可能です。
また、ZsGreen1遺伝子をNot Iで切り出すことができる配列となっており、目的遺伝子をクローニングすることが可能です。クローニングにはIn-Fusion Snap Assembly Master Mix(製品コード 638947、638948、638949、638943、638944)を使用することを強く推奨します。
(ただし、AAV粒子に封入されるDNAサイズには制限があるため、挿入する目的遺伝子のサイズは2.8 kb以内にしてください。)
ITR配列間に、CMVプロモーター制御下で発現するZsGreen1遺伝子が配置されており、このプラスミドを用いてAAVを作製することで、ZsGreen1を発現するAAVを効率よく作製可能です。
また、ZsGreen1遺伝子をNot Iで切り出すことができる配列となっており、目的遺伝子をクローニングすることが可能です。クローニングにはIn-Fusion Snap Assembly Master Mix(製品コード 638947、638948、638949、638943、638944)を使用することを強く推奨します。
(ただし、AAV粒子に封入されるDNAサイズには制限があるため、挿入する目的遺伝子のサイズは2.8 kb以内にしてください。)
本製品使用の実験例
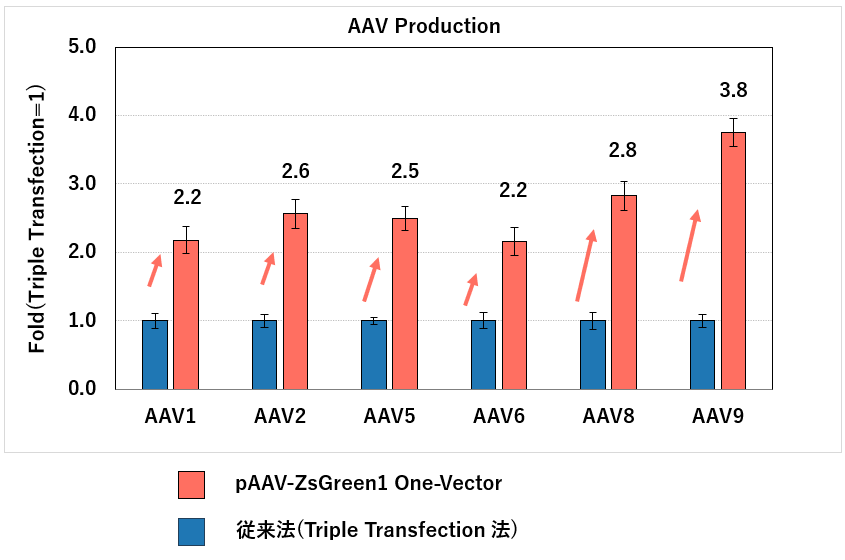
図1.従来法(Triple Transfection法)とのAAV産生量の比較
接着HEK293T細胞を用いてpAAV-ZsGreen1 One-Vectorと従来法(Triple Transfection法*)でZsGreen1発現AAVベクターを調製、回収し、それぞれの力価をAAVpro Titration Kit (for Real Time PCR) Ver.2(製品コード 6233)で測定し、その結果、従来法と比較して、pAAV-ZsGreen1 One-Vectorではどの血清型においてもより多くのAAVベクターを産生することが示された(Foldは従来法を1とした時のpAAV-ZsGreen1 One-Vectorのウイルス産生量の比率を示している)。
*AAV pro Helper Free Systemを使用してAAVベクターを調製した。
(製品コード 6673、6230、6650、6651、6680、6690)
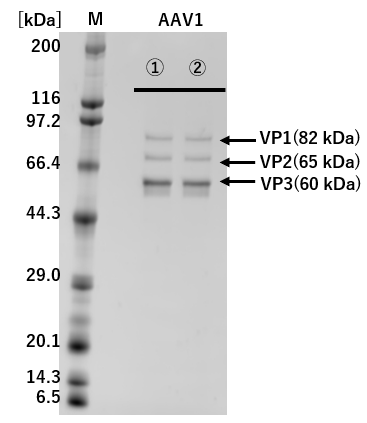
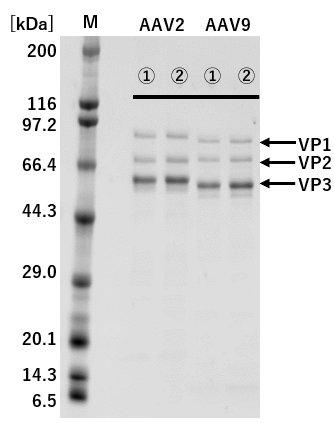
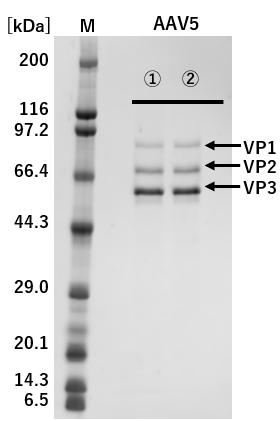
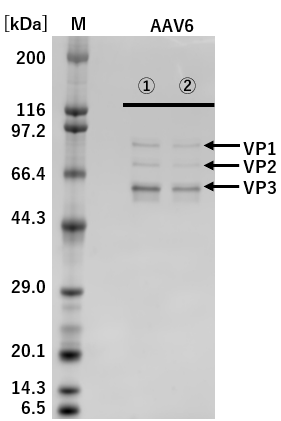
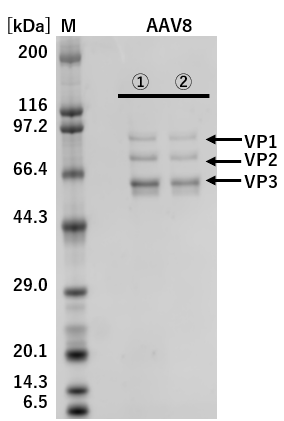
①: 従来法(Triple Transfection法) ②: pAAV-ZsGreen1 One-Vector
M: Protein Molecular Weight Marker(Broad)
図2.従来法(Triple Transfection法)とのAAVキャプシドタンパク質発現の比較
pAAV-ZsGreen1 One-Vectorと従来法(Triple Transfection法)でそれぞれZsGreen1発現AAVベクターを調製し、精製したAAVベクターを1×109 vg/laneでSDS-PAGEに供じた。
その結果、VP1、VP2、およびVP3は、従来法(Triple Transfection法)と大きな差は認められなかった。
表1.rcAAV(replication-competent AAV)の検出確認
| AAV(vg/well) | Ct | |
| pAAV-ZsGreen1 One-Vector | 2×1011 vg | -- |
| 従来法(Triple Transfection法) | 2×1011 vg | -- |
| P.C(wtAAV2) | 2×102 vg | 24.2 |
| 2×101 vg | -- | |
| N.C | - | -- |
pAAV-ZsGreen1 One-Vectorおよび従来法(Triple Transfection法)で作製・精製したAAV2ベクター(2×1011 vg)とアデノウイルス(MOI=5)をHEK293細胞に共感染させた。その後、感染細胞から抽出液を調製し、その細胞抽出液を再度接着HEK293細胞にアデノウイルスと共感染させた後、AAVpro Titration Kit (for Real Time PCR) Ver.2(製品コード 6233)を用いたqPCRによりAAVの有無を確認した。
pAAV-ZsGreen1 One-Vectorおよび従来法で作製したZsGreen1発現AAVベクターはいずれもCt値は検出されなかった。したがって、両者におけるrcAAV発生リスクに差は認められなかった。
また、P.C(野生型AAV2)を用いて同様の試験を行ったところ、2×102 vg/wellが検出限界であることが確認された。
以上の結果より、pAAV-ZsGreen1 One-Vectorで作製したZsGreen1発現AAVベクター(2×1011 vg/well)において、AAVは検出限界以下であり、rcAAVは2×102 vg未満であることが示された。このことから理論上AAVベクター1×109 vg中にはrcAAVは存在しない(1以下)ことが示唆された。
*AAV作製時にrepおよびcap遺伝子を除いて目的遺伝子を挿入するが、非相同組換えによって自己複製可能なAAVがごく稀に発生することがある。
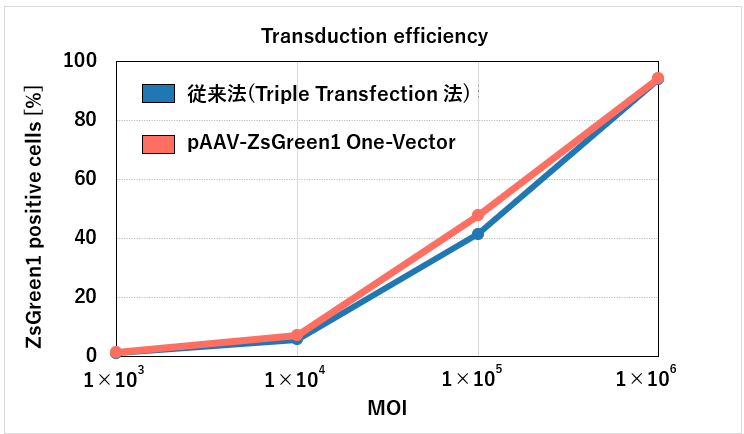
図3.遺伝子導入効率の検証(フローサイトメトリー法)
接着HEK293T細胞を用いて、pAAV-ZsGreen1 One-Vectorと従来法(Triple Transfection法)でAAV9-CMV-ZsGreen1ベクターを作製・精製した。得られたZsGreen1発現AAVベクターをHeLa細胞に各MOIで感染させ、3日後にフローサイトメーターで遺伝子導入効率を解析した。その結果、pAAV-ZsGreen1 One-Vectorによる遺伝子導入効率は従来法と比較して同等の結果であった。
ベクターマップ
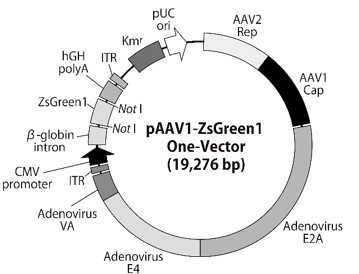
図4.pAAV1-ZsGreen1 One-Vector

図5.pAAV2-ZsGreen1 One-Vector
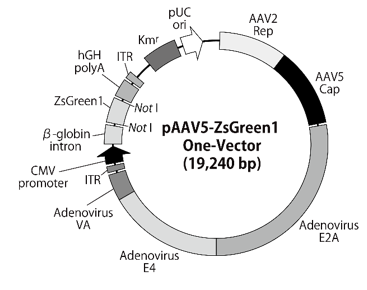
図6.pAAV5-ZsGreen1 One-Vector
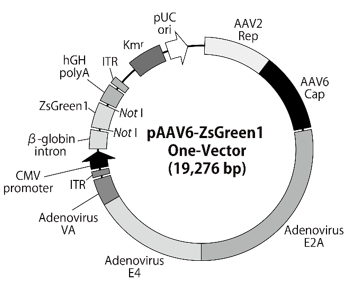
図7.pAAV6-ZsGreen1 One-Vector
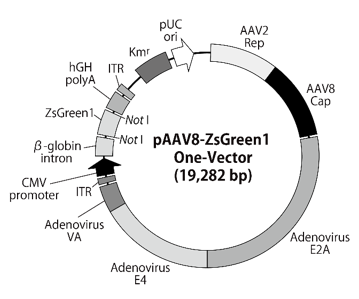
図8.pAAV8-ZsGreen1 One-Vector
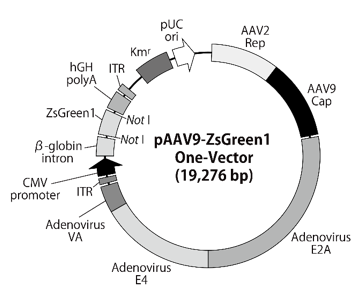
図9.pAAV9-ZsGreen1 One-Vector
各ベクターのシーケンスデータ
ZIP形式で圧縮しております。
保存
-20℃
使用上の注意
本製品をご利用の際は、以下の点にご注意ください。
- 本製品の使用対象であるアデノ随伴ウイルスベクターの使用には文部科学省の定める省令(「研究開発等に係る遺伝子組換え生物等の第二種使用等に当たって執るべき拡散防止措置等を定める省令」平成16年文部科学省・環境省令第1号)にあるP1レベル以上の施設が必要です。
- 本製品ご利用の際は省令および組織内の組換えDNA実験安全委員会の指示に従い、安全には十分ご注意ください。
- アデノ随伴ウイルスベクターによって生産されるウイルスは挿入断片によっては危険なウイルスを含む恐れがあるため、組換えウイルスの生産と取扱いには、適切な処置をとる必要があります。吸入や付着を防ぐために必ず、安全キャビネットを使用してください。
- 本製品の使用には遺伝子工学と細胞培養に関する基本的な技術が必要です。
- 本製品の使用によって生じたいかなる事故、損害についても、弊社では責任を負いかねますので、ご了承の上ご使用ください。
Application
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。