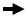製品説明
TransduceIT Transduction Reagentは臭化ヘキサジメトリン(hexadimethrine bromide)溶液であり、レンチウイルスによる遺伝子導入効率の向上に汎用的に利用されている。
TransIT-VirusGEN Transfection Reagent(reagent:DNA(vol:wt)=2:1)、A社製品1、A社製品2、25 kDaポリエチレンイミン(PEI)を用いて、浮遊培養したFreeStyle 293-F細胞(FreeStyle F17 Mediumで培養)(A)、または接着培養した293T/17細胞 (B)にpAAV-hrGFP、pAAV-RC、pAAV-Helper (1:1:1 ratio, 1.5 μg/ml, Agilent Technologies)をトランスフェクションした。抽出したウイルスをHT1080細胞に感染させ、48時間後にGFPの発現をフローサイトメーターにより測定した。
Functional titerはGFP陽性細胞が20%未満となるウイルス希釈率より求めた。エラーバーは3ウェルの標準偏差を示す。
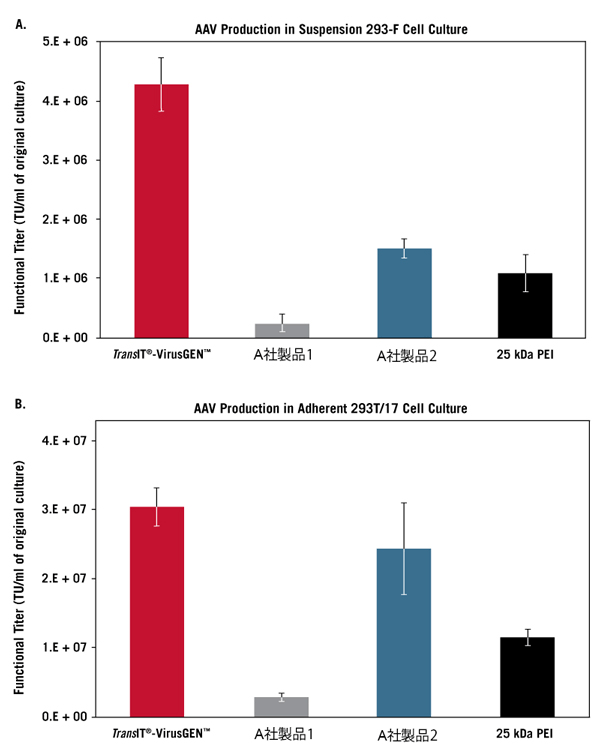
TransIT-VirusGEN Transfection Reagent(reagent:DNA(vol:wt)=3:1)、A社製品1、A社製品2、25 kDaポリエチレンイミン(PEI)を用いて、浮遊培養したFreeStyle 293-F細胞(FreeStyle F17 Mediumで培養)(A)、または接着培養した293T/17細胞 (B)にpLKO.1-puro-CMV-TurboGFP transfer vector、MISSION Lentivirus Packaging Mix(1:1 ratio, 1 μg/ml)をトランスフェクションした。培養上清を0.45 μmフィルターで濾過後、8 μg/ml TransduceIT存在下で293T/17に感染させ、72時間後にGFPの発現をフローサイトメーターにより測定した。
Functional titerはGFP陽性細胞が20%未満となるウイルス希釈率より求めた。エラーバーは3ウェルの標準偏差を示す。

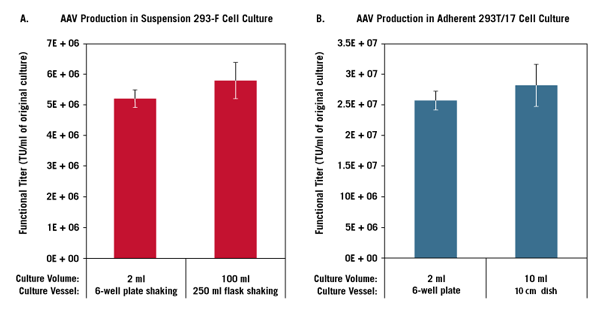
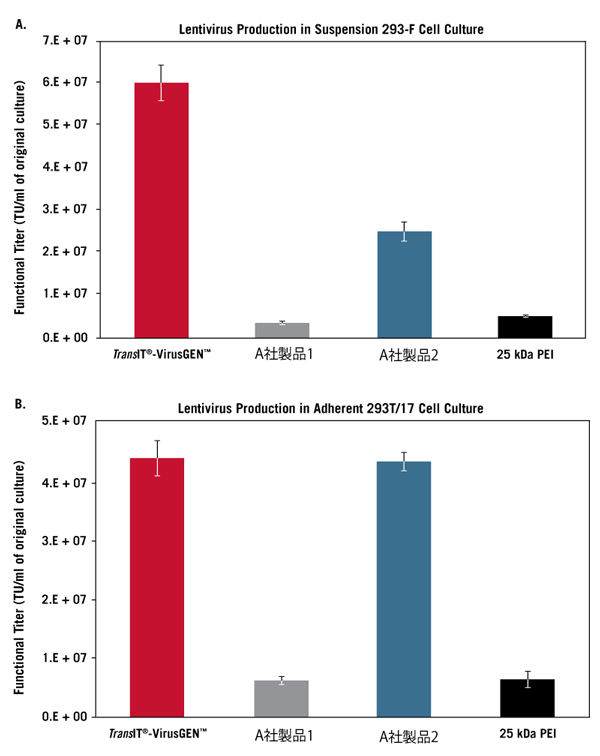
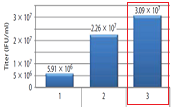
異なる培養容器、培養液量で浮遊培養したFreeStyle 293-F細胞(FreeStyle F17 Mediumで培養)(A)、または接着培養した293T/17細胞 (B)に、TransIT-VirusGEN Transfection Reagentを用いてpAAV-hrGFP、pAAV-RC、pAAV-Helper (1:1:1 ratio, 1.5 μg/ml, Agilent Technologies)をトランスフェクションした(reagent:DNA(vol:wt)=2:1)。抽出したウイルスをHT1080細胞に感染させ、48時間後にGFPの発現をフローサイトメーターにより測定した。
Functional titerはGFP陽性細胞が20%未満となるウイルス希釈率より求めた。エラーバーは3ウェル/フラスコ/ディッシュの標準偏差を示す。
保存
トランスフェクション試薬選択 オンラインツール
◆選択ガイド
効率的な試薬の選択にご活用ください。
◆検索ツール
| “Reagent Agent”は、Mirus社が提供するトランスフェクション試薬の検索ツールです。 細胞と導入する核酸の種類から、推奨されるトランスフェクション試薬を検索することができます。 |

|
この製品を見た人は、
こんな製品も見ています
-

TransIT®-293 Reagent
特定の細胞株に最適化したトランスフェクション試薬
-
AAVpro® Helper Free System
ヘルパーフリーシステムによるAAVベクターの作製
-
Lentiviral High Titer Packaging Mix with pLVSINシリーズ
-

遺伝子導入試薬 選択ガイド(Mirus社)
実験目的と標的細胞から最適な遺伝子導入試薬を選択!
-
AAVpro® Purification Kit Maxi/Midi (All Serotypes)
様々な血清型アデノ随伴ウイルスベクターに適用できる高効率な精製キット
-

AAV qPCR(リアルタイムPCR)迅速タイター測定キット
様々なアデノ随伴ウイルス(AAV)ベクターの力価測定が可能
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。