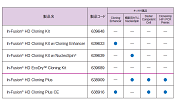
製品説明
In-Fusion反応では、PCR断片と線状化ベクターの両末端15塩基の相同配列を利用して効率よくクローニングする。この15塩基の相同配列はPCR用プライマーの設計により容易に付加できる。In-Fusion Snap Assembly Master Mixによって線状DNAの3'末端から塩基が除去され、2個のDNA断片間で生じる相補的塩基によりアニーリングが可能となり、DNA断片の結合が起こる。この原理により1個から複数の断片のクローニングが可能となる。さらに、変異導入、遺伝子合成、特定遺伝子領域の変換などにも利用できる。
In-Fusion Snap Assembly Master Mixは、In-Fusion HD Cloning Kitのバージョンアップ品であり、In-Fusion HDや他社同タイプキットと比べてクローニング効率が向上している。
他社同等品との違いはこちら
In-Fusionと他社シームレスクローニングキットは何が違うの?
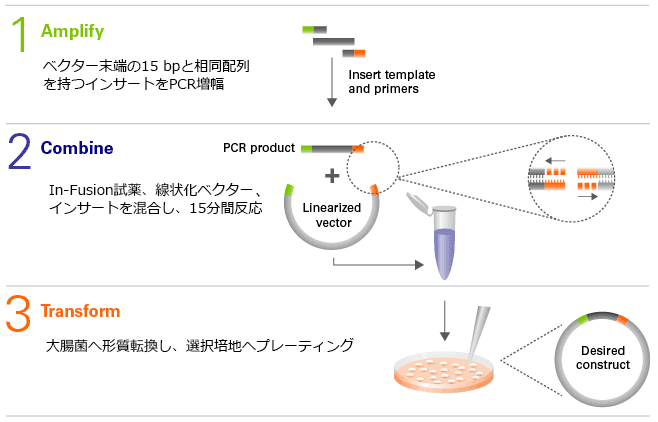
図1.プロトコール
In-Fusion反応の概略
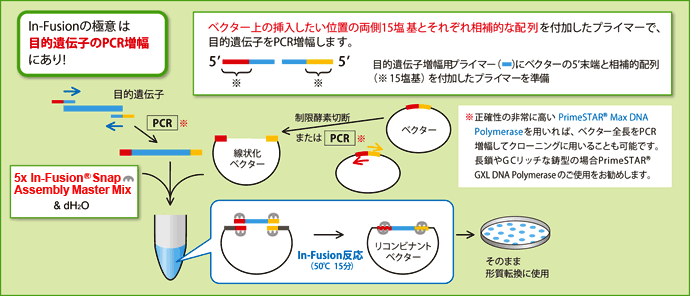
図2. In-Fusionクローニング
- 利用するベクターの末端配列に相同な15塩基を、目的遺伝子増幅用プライマーの5'末端に付加し、目的遺伝子をPCR増幅する。
- 増幅産物がシングルバンドであればカラム精製、またはCloning Enhancer処理を行い、複数のバンドが見られる場合はゲルから精製して、In-Fusion酵素で線状化ベクター*と結合する(In-Fusion反応:50℃、15分)。
Cloning Enhancer(製品コード 639613~639615)は、PCR産物をそのままIn-Fusion反応に使用するための独自の前処理試薬である。PCR終了後の反応液に本試薬を加えて30分間インキュベートするだけで、そのままIn-Fusion反応に使用できる。PCR産物の精製ステップが不要となり、試料のロスも少なくなる。 - In-Fusion反応液で形質転換を行い、目的クローンをスクリーニングする。
他社同等品との違いはこちら
>>In-Fusionと他社シームレスクローニングキットは何が違うの?
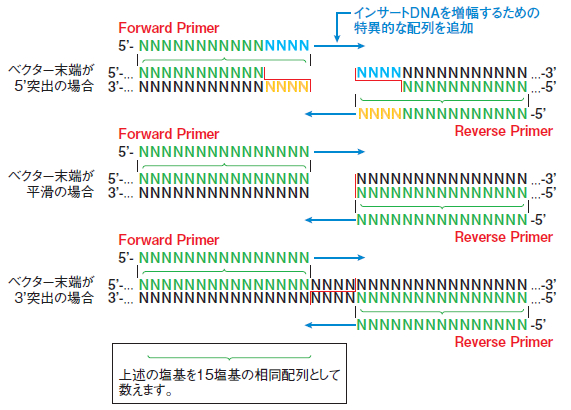
In-Fusionプライマーの設計
お手持ちのベクターに対するIn-Fusion用プライマーの設計には、便利なオンラインツール「In-Fusion クローニング用プライマー設計サイト(In-Fusion Cloning Primer Design Tool)」をご利用ください。

※ リンク先はTB USA社サイトです。デザインツールが更新され、より使いやすくなりました。
※ これまでお使いいただいていた「In-Fusionクローニング用プライマー設計サイト(Primer Design tool for In-Fusion)」はこちらから
性能比較データ
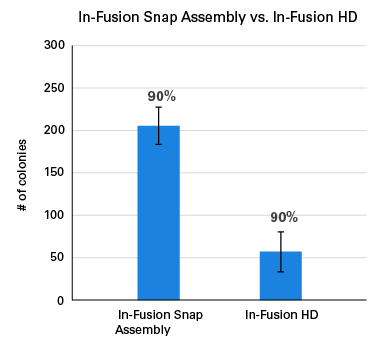
図3.In-Fusion HDとの比較
In-Fusion Snap AssemblyとIn-Fusion HDを使用し、インバースPCRで予め線状化した2.7 kbのベクターに5つの異なるサイズのインサート(405 bpから1,005 bpまで)を同時にクローニングした。各クローニング反応を3連で行い、得られたコロニー数を比較した。クローニングの正確性を確認するため、形質転換およびプレーティング後、各レプリケートから10個のコロニーを選択してシーケンスを行い、目的の配列が正しく挿入されているかを確認した。
In-Fusion Snap Assemblyを使用した場合、In-Fusion HDの4倍以上のコロニーが得られた。また、選択したコロニーのうち90%以上に正しい配列が挿入されていることを確認した。
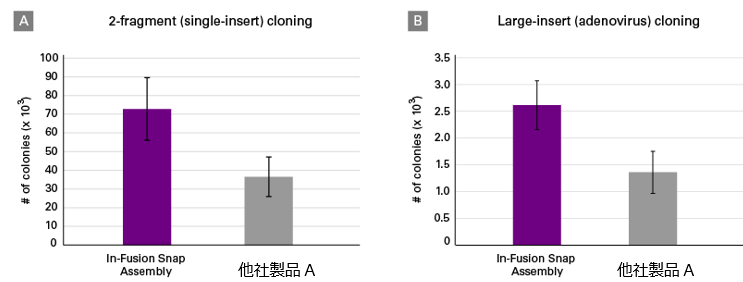
図4.他社同タイプキットとの比較(インバースPCRによりベクターを線状化)
In-Fusion Snap Assemblyと他社同タイプキット(他社製品A)を用いて、3.8 kb インサートDNA(グラフA)または34.2 kbアデノウイルスDNA(グラフB)を2.7 kb線状化ベクターへクローニングした。クローニング反応はそれぞれ3連で行った。形質転換後、各反応からそれぞれ20コロニーについて、シーケンス(グラフA)またはコロニーPCR(グラフB)によりクローニング精度を調べた。
In-Fusion Snap Assemblyを使用した場合、他社製品Aの2倍以上のコロニーが得られた。また、選択したコロニーのうち95%以上に正しい配列が挿入されていることを確認した。
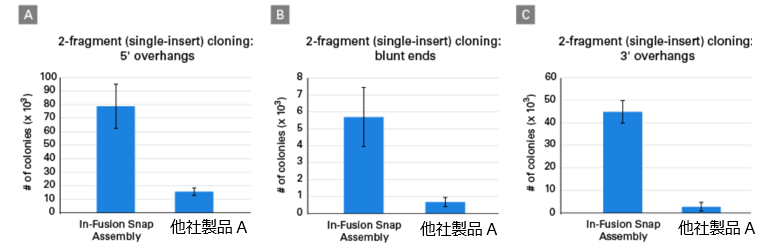
図5.他社同タイプキットとの比較(制限酵素処理によりベクターを線状化)
In-Fusion Snap Assemblyと他社同タイプキット(他社製品A)を用いて、制限酵素処理により作成された5'突出末端(グラフA)、平滑末端(グラフB)、3'突出末端(グラフC)の単一インサート(3.8 kb)を線状化された標準的なベクターにクローニングした。クローニング反応を3連で行い、得られたコロニー数を比較した。各レプリケートから20個のコロニーを選択してシーケンスを行い、目的の配列が正しく挿入されているかを確認した。
In-Fusion Snap Assemblyを使用した場合、他社同タイプキットの5倍~16倍以上のコロニーが得られた。また、選択したコロニーのうち95%以上に正しい配列が挿入されていることを確認した。
内容
- In-Fusion Snap Assembly Master Mix※ (製品コード 638947、638948、638949、638943、638944)
-
- 5X In-Fusion Snap Assembly Master Mix
- pUC19 Control Vector, linearized
- 2 kb Control Insert
- In-Fusion Snap Assembly Master Mix with Competent Cells※ (製品コード 638951、638952)
-
- 5X In-Fusion Snap Assembly Master Mix
- pUC19 Control Vector, linearized
- 2 kb Control Insert
- pUC19 Vector
- SOC Medium
- Stellar Competent Cells(製品コード 636763)
保存
638951、638952
competent cells:−80℃
その他のコンポーネント:−20℃
Application
ユーザー様実施例:遺伝子のクローニング
ユーザー様実施例:In-Fusionを用いた変異プラスミドライブラリーの作製
ユーザー様実施例:酵母ツーハイブリッド法、トランジェントアッセイ用プラスミドの作製
ユーザー様実施例:2つのインサートをIn-Fusion Snap Assembly Master Mixで同時クローニング
ユーザー様実施例:標的タンパク質の細胞内局在を確認するための蛍光タグ付き標的タンパク質発現プラスミドの作製
ユーザー様実施例:In-Fusion Cloning Kitを用いた4断片マルチクローニングの成功
In-Fusion® HD Cloning KitとA社同等品の比較実験(TB USA社取得データ)
ユーザー様実施例:In-Fusion® Cloning Systemを用いて3つのPCR productからベクターを構築
ユーザー様実施例:3つのインサートをIn-Fusion® Cloning Systemで同時にクローニング(他社同等キットとの比較)
ユーザー様実施例:4つのインサートをIn-Fusion® Cloning Systemで同時にクローニング
ユーザー様実施例:In-Fusion® Cloning Kitと他社同タイプキットの比較実施例
ユーザー様実施例:In-Fusion® Cloning Systemを用いたゲノム編集ノックイン用ドナーベクターの構築(3断片のマルチクローニング)
ユーザー様実施例:In-Fusion® Cloning Kitを使用したAAVベクターの改変
長鎖フラグメントのクローニング
複数フラグメントの同時クローニング
In-Fusion反応におけるインサートサイズとクローニング効率
In-Fusion簡易プロトコールによる2断片の同時クローニング
ユーザー様実施例:P2A配列の挿入
ユーザー様実施例:人工ライブラリの作製
ユーザー様実施例:訳あって、PCR産物を制限酵素処理できない時
Technical Notes
In-Fusionを用いた変異の少ない正確な目的配列のクローニング(日本語)
モノクローナル抗体開発のための迅速、確実なハイスループットクローニング(日本語)
In-Fusionを用いたsgRNAの簡単クローニング(日本語)
In-Fusionクローニングによる簡単な遺伝子設計(日本語)
In-Fusion 技術を用いたシグナル伝達系タンパク質ドメイン発現
コンストラクトの正確なハイスループット・クローニング(日本語)
クロンテック製品の組合せ使用による簡単・迅速なタンパク質の発現と精製(日本語)
In-Fusionによる複数断片の正確かつ効率的な同時クローニング(英語)
モノクローナル抗体開発で迅速、確実なハイスループット・クローニングが可能(英語)
In-Fusion Snapモニター結果大発表!
In-Fusionユーザーズボイス一挙ご紹介
クローニング実験アンケートの結果
In-Fusionについて3つの動画でわかりやすくご紹介!
In-Fusionと他社シームレスクローニングキットは何が違うの?
Online Tools for In-Fusion® Cloning
使用文献・参考文献
関連製品・受託
In-Fusion® Snap Assembly EcoDry™ Master Mix
PrimeSTAR® Max DNA Polymerase
NucleoSpin® Gel and PCR Clean-up
E. coli Competent Cells一覧(タカラバイオ製)
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。