製品ご購入に際しては、添付の購入確認書に必要事項を記入の上、ご注文の際に弊社販売店までお渡しください。本確認書が添付されていない場合は製品の出荷ができませんのでご注意ください。
ご質問は下記へご連絡ください。
ご質問は下記へご連絡ください。
タカラバイオ(株) 営業推進部 担当
TEL:077-565-6972 FAX:077-565-6987 購入確認書
TEL:077-565-6972 FAX:077-565-6987 購入確認書
製品説明
LVpro Packaging Mixは、レンチウイルスベクター調製に必要なコンポーネントを発現するプラスミドを最適な比率で混合し、パッケージングに必要なコンポーネントを最適な比率で発現するよう設計することで、高力価のレンチウイルスベクターを得ることを可能にした製品です。また、5’LTRのU3領域をCMVプロモーターに置き換えたtat非依存性の第3世代レンチウイルスベクターであるpLVproレンチウイルスベクタープラスミドと組み合わせて用いることで、HIV-1由来tatの発現なしにレンチウイルスベクターの作製が可能となっています。導入したいpLVproレンチウイルスベクタープラスミドとLVpro Packaging Mix をLenti-X 293T細胞にコトランスフェクトすることで、LVpro Packaging MixよりHIV-1由来のGag、Pol、Revのレンチウイルスタンパク質と、VSV-G エンベロープタンパク質が一過性に発現されます。そして、pLVproレンチウイルスベクタープラスミドから転写された組換えウイルスRNAは完全なウイルス粒子の中に取り込まれます(図1)。この最適化されたLVpro Packaging MixとLenti-X 293T細胞、さらに高効率トランスフェクション試薬TransIT-VirusGEN Transfection Reagent(製品コード MIR6700)もしくはTransIT-293 Transfection Reagent(製品コード MIR2700)の組み合わせにより、高いウイルス力価を有するレンチウイルスベクター液を取得することができ、多くの場合、取得したレンチウイルスベクター液を濃縮することなく、直接、標的細胞の感染に使用できます。
※LVpro Packaging MixとpLVSINレンチウイルスベクタープラスミド(製品コード 6181~6186)との組み合わせでは、レンチウイルスは取得できません。
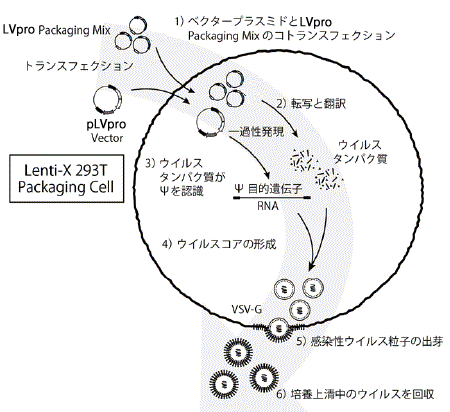
図1.LVpro Packaging MixとLenti-X 293T細胞を用いたレンチウイルスの産生
LVpro Packaging Mixと目的遺伝子を挿入したpLVproレンチウイルスベクタープラスミドをコトランスフェクトする(ステップ1)と、対応する組換えレンチウイルスゲノムRNA転写物とウイルスパッケージングタンパク質が産生されます(ステップ2)。組換えウイルスRNAゲノム上のパッケージング配列(Ψ)がパッケージングタンパク質に認識されると(ステップ3)、組換えウイルスRNAゲノムがパッケージングタンパク質に取り込まれてウイルスコアが形成され、コアが細胞膜に輸送されます(ステップ4)。その場所で、コアはVSV-Gエンベロープタンパク質を含む細胞膜によって包まれます。成熟した感染性のビリオン(ウイルス粒子)が細胞から出芽し(ステップ5)、培地中に放出されます。培地からウイルス粒子を回収します(ステップ6)。
回収したウイルス粒子は感染力がありますが、標的細胞内での複製・増殖に必要ないくつかの遺伝子を欠いています。ウイルスタンパク質を発現するのに必要なプラスミドを複数用いているため、頻度の低い組換えが何度も起こらないと、複製能をもつウイルスは生成しません。その意味で、この方法は非常に安全なウイルス生産法といえます。
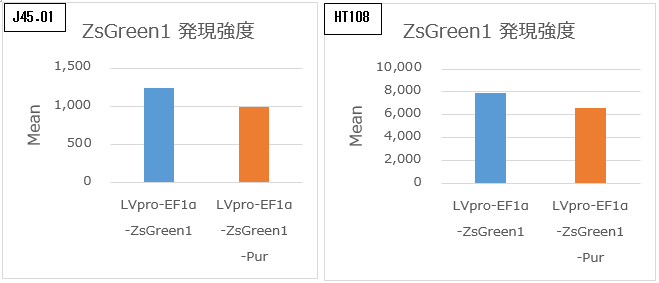
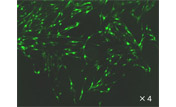
図2. Puromycin耐性遺伝子搭載による目的遺伝子の発現
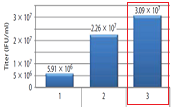
通常、Puromycinなどの薬剤耐性遺伝子をレンチウイルスベクターに挿入することで、目的遺伝子発現の低下が見られる場合があります。pLVpro-EF1α-ZsGreen1-Pur VectorおよびpLVpro-EF1α-ZsGreen1 VectorとLVpro Packaging Mixをコトランスフェクトしてレンチウイルスを取得しました。得られたZsGreen1発現レンチウイルスベクターを各種の細胞に遺伝子導入し、フローサイトメーターを用いてZsGreen1陽性細胞の発現強度を測定しました。Puromycin耐性遺伝子を搭載したpLVpro-EF1α-ZsGreen1-Pur Vectorにおいても、Puromycin遺伝子を搭載していないpLVpro-EF1α-ZsGreen1 Vectorの約80%のZsGreen1発現が見られました。
※LVpro Packaging MixとpLVSINレンチウイルスベクタープラスミド(製品コード 6181~6186)との組み合わせでは、レンチウイルスは取得できません。

図1.LVpro Packaging MixとLenti-X 293T細胞を用いたレンチウイルスの産生
LVpro Packaging Mixと目的遺伝子を挿入したpLVproレンチウイルスベクタープラスミドをコトランスフェクトする(ステップ1)と、対応する組換えレンチウイルスゲノムRNA転写物とウイルスパッケージングタンパク質が産生されます(ステップ2)。組換えウイルスRNAゲノム上のパッケージング配列(Ψ)がパッケージングタンパク質に認識されると(ステップ3)、組換えウイルスRNAゲノムがパッケージングタンパク質に取り込まれてウイルスコアが形成され、コアが細胞膜に輸送されます(ステップ4)。その場所で、コアはVSV-Gエンベロープタンパク質を含む細胞膜によって包まれます。成熟した感染性のビリオン(ウイルス粒子)が細胞から出芽し(ステップ5)、培地中に放出されます。培地からウイルス粒子を回収します(ステップ6)。
回収したウイルス粒子は感染力がありますが、標的細胞内での複製・増殖に必要ないくつかの遺伝子を欠いています。ウイルスタンパク質を発現するのに必要なプラスミドを複数用いているため、頻度の低い組換えが何度も起こらないと、複製能をもつウイルスは生成しません。その意味で、この方法は非常に安全なウイルス生産法といえます。

図2. Puromycin耐性遺伝子搭載による目的遺伝子の発現
通常、Puromycinなどの薬剤耐性遺伝子をレンチウイルスベクターに挿入することで、目的遺伝子発現の低下が見られる場合があります。pLVpro-EF1α-ZsGreen1-Pur VectorおよびpLVpro-EF1α-ZsGreen1 VectorとLVpro Packaging Mixをコトランスフェクトしてレンチウイルスを取得しました。得られたZsGreen1発現レンチウイルスベクターを各種の細胞に遺伝子導入し、フローサイトメーターを用いてZsGreen1陽性細胞の発現強度を測定しました。Puromycin耐性遺伝子を搭載したpLVpro-EF1α-ZsGreen1-Pur Vectorにおいても、Puromycin遺伝子を搭載していないpLVpro-EF1α-ZsGreen1 Vectorの約80%のZsGreen1発現が見られました。
内容
- LVpro Packaging Mix(製品コード 6195)
- LVpro Packaging Mix 60 回*1(140 μl×3)
*1 100 mm dish使用の場合の回数です。 - LVpro Packaging Mix (pLVpro-CMV-Pur Vector)(製品コード 6973)
- LVpro Packaging Mix (pLVpro-EF1α-Pur Vector)(製品コード 6974)
- LVpro Packaging Mix (pLVpro-CMV-ZsGreen1-Pur Vector)(製品コード 6975)
- LVpro Packaging Mix (pLVpro-EF1α-ZsGreen1-Pur Vector)(製品コード 6976)
-
製品コード 6973 ~ 6976 は、LVpro Packaging Mix(製品コード 6195) と各 pLVpro-Pur Vector(製品コード 6969~6972)*2のセットです。
*2 pLVpro-Pur Vectorは個別に販売していません。
容量:20 µg、濃度:0.5 µg/µl
※Puromycin耐性遺伝子を含まないLVpro Packaging Mix with pLVproシリーズ(製品コード 6962~6967)も販売しています。
| ベクター | 鎖長 | 利用可能な制限酵素サイト(MCS) |
|---|---|---|
| pLVpro-CMV-Pur Vector | 7,493 bp | BamH I、Sse8387 I、Not I、Mlu I、Xho I、Apa I、Smi I、Xba I |
| pLVpro-EF1α-Pur Vector | 8,170 bp | BamH I、Sse8387 I、Not、Mlu I、Smi I、Xba I |
| pLVpro-CMV-ZsGreen1-Pur Vector | 8,201 bp | - |
| pLVpro-EF1α-ZsGreen1-Pur Vector | 8,878 bp | - |
DNAシーケンスデーター
ZIP形式で圧縮しておりますが、StuffIt Expander等でも解凍できます。
その他必要な試薬など
- パッケージング細胞
- Lenti-X 293T Cell Line(製品コード 632180) ウイルス生産に最適化されたHEK 293T由来細胞株であり、高いトランスフェクション効率を示します。
- 試薬類
-
- 下記のうちいずれかのトランスフェクション試薬*1
- TransIT-VirusGEN Transfection Reagent(製品コード MIR6700)
- TransIT-293 Transfection Reagent(製品コード MIR2700)
- CalPhos Mammalian Transfection Kit(製品コード 631312)
- ポジティブコントロール用ベクター*2
d. pLVpro-CMV-ZsGreen1-Pur Vector(ポジティブコントロール用:製品コード 6971)
e. pLVpro-EF1α-ZsGreen1-Pur Vector (ポジティブコントロール用:製品コード 6972)
*1 a、bは安定して高力価のレンチウイルスを取得するのに適しており、cは比較的安価にトランスフェクションを行うことができます。本製品を使用して高力価のレンチウイルスを取得するにはTransIT-VirusGEN Transfection Reagentの使用を推奨します。
*2 d、eは蛍光タンパク質であるZsGreen1 を発現するレンチウイルスベクタープラスミドであり、トランスフェクション効率の確認や、調製したレンチウイルスの生物学的力価を確認するためのポジティブコントロールとして使用するのに便利です。感染させる細胞の種類によって搭載プロモーターをご選択いただくことをお勧めいたします。 - Puromaycin
- 下記のうちいずれかのトランスフェクション試薬*1
- 力価測定
-
正確で再現性のある遺伝子導入のために、レンチウイルスストック液の力価測定を強く推奨します。Lenti-X qRT-PCR Titration Kit(製品コード 631235)は、qRT-PCRを利用した迅速・簡便な力価測定キットです。本キットではインターカレーター法のリアルタイムPCRによりウイルスRNAゲノムの存在量(RNAタイター)を調べることで、ウイルスストック液の力価を約4時間で測定できます。Lenti-X p24 Rapid Titer Kit(製品コード 632200)では、ELISA法を用いてウイルス上清中のp24キャプシドタンパク質の量を測定します。測定したp24キャプシドタンパク質量はウイルス力価と相関します。
また、Lenti-X GoStix Plus(製品コード 631280/631281)を用いると、ウイルス上清20 μlを使用して10分でレンチウイルスp24を検出してウイルス力価を簡易判定できます。ウイルス上清を回収するか、まだ培養を続けるかを判断するためにも有用です。 - 組換えレンチウイルスの精製
- ウイルスを精製することで、遺伝子導入実験に悪影響を及ぼすおそれがある細胞夾雑物を除去することができます。Lenti-X Maxi Purification Kit(製品コード 631233/631234)は、クルードな上清から高純度レンチウイルスを精製するためのキットで、自然落下カラムを用いたプロトコールにより、インタクトで機能的なレンチウイルスを簡単、迅速、高効率で得ることができます。
- 組換えレンチウイルスの濃縮
- Lenti-X Concentrator(製品コード 631231/631232)を用いると、超遠心を行わずにウイルス力価を100倍まで濃縮できます。濃縮されたレンチウイルスを用いることで高いMOIで標的細胞に感染できます。
- 組換えレンチウイルスの感染効率アップ
- RetroNectin (Recombinant Human Fibronectin Fragment)(製品コード T100A/B)は組換えフィブロネクチン断片(CH-296)で、レトロウイルスやレンチウイルスによる遺伝子導入効率を大きく向上させることができます。RetroNectinは、組織培養プレート(ノントリートメント)にコーティングすることで、ウイルスと細胞の両方が結合する基質(substratum)となります。この基質にウイルスと細胞が同時に接着することにより、細胞とウイルスの接触が増大し、遺伝子導入が促進されます。RetroNectinは、特に浮遊細胞(リンパ球やリンパ球細胞株など)や遺伝子導入が困難な細胞(造血幹細胞など)、あるいはポリブレンに特に弱い細胞に有用です。
保存
-20℃
使用上の注意
- 本製品の使用には遺伝子工学と細胞培養に関する基本的な技術が必要です。
- 本製品の使用には文部科学省の定める省令(「研究開発等に係る遺伝子組換え生物等の第二種使用等に当たって執るべき拡散防止措置等を定める省令」平成16年文部科学省・環境省令第1号)にあるP2レベル以上の施設が必要です。(→説明書の「バイオセーフティーについて」を参照してください。)
- 本レンチウイルスベクターの系によって生産されるウイルス上清は、挿入断片によっては危険なウイルスを含む恐れがあるため、組換えレンチウイルスの生産と取扱いには、適切な処置をとる必要があります。吸入や付着を防ぐため、必ず、安全キャビネットを使用してください。
- 本製品の使用はすべて研究用に限定されています。臨床目的での使用および生体外診断に使用することはできません。
- 本製品ご利用の際は省令および組織内の組換えDNA安全委員会の指示に従い、安全には十分ご注意下さい。
- 本製品の使用によって生じたいかなる事故、損害についても、弊社では責任を負いかねますので、ご了承の上ご使用下さい。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- ライセンスに関する情報は製品名横のライセンスアイコンからご覧ください。
関連製品・受託
LVpro™ Packaging Mix with pLVproシリーズ
TransIT-VirusGEN® Transfection Reagent
TransIT®-293 Reagent
CalPhos™ 哺乳類細胞用トランスフェクション試薬
Lenti-X™ 293T細胞株
レンチウイルスqRT-PCR迅速タイター測定キット
Lenti-X™ p24 ELISAタイター測定キット
Lenti-X™ GoStix™ Plus(簡易レンチウイルス量測定試薬)
Lenti-X™ Maxi Purification Kit
Lenti-X™ レンチウイルス濃縮試薬
RetroNectin® (Recombinant Human Fibronectin Fragment)
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。