製品説明
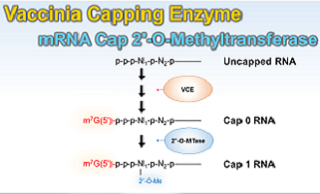
Faustovirus Capping Enzyme (S17) (以下、FCE)は、Faustovirus S17株由来のシングルサブユニットからなる酵素であり、Vaccinia Capping Enzyme(製品コード 2460A/B)(以下、VCE)のようなVacciniaウイルス由来のキャップ化酵素と同様の作用機序でRNA(5’-triphosphate RNA)の5’末端に7-methylguanylate cap構造(Cap 0)を付加します。本製品に含まれる試薬(10×Capping Buffer 2、S-adenosylmethionine(SAM)、およびGTP)と共に使用することで、完全なCap 0構造を持つRNAをin vitroにおいて効率的に調製できます。
また、本酵素をmRNA Cap 2’-O-Methyltransferase(製品コード 2470A/B)(以下、2’-O-MTase)と同時に使用する場合には、Cap-0 RNAの1番目のヌクレオチドの2’-O部位がメチル化されたCap 1構造を持つRNAをシングルステップ反応で調製することも可能です*。
本酵素は、VCEと比べ、より広範囲な温度での活性を示し(30~50℃)(図1)、様々なRNAに対して頑強性を示すため、ワクチンなどのRNA医薬分野での研究開発に有用です。
「特記事項」
*Uncapped RNA(IVT合成した5’-triphosphate RNA)を元に1-stepでCap-1 RNAを調製する場合、2’-O-MTase(製品コード 2470A/B)に付属のバッファーではなく、FCE用に最適化された10×Capping Buffer 2をご使用ください。
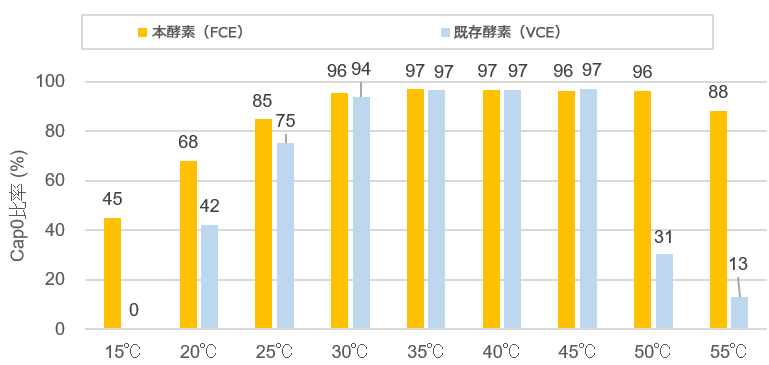
図1.反応温度とCapping効率
本酵素(FCE)と既存酵素(VCE)を用いて、それぞれCapping反応を行い、LCMSでCapping効率(Cap 0比率)を測定した。FCEはVCEに比べ、幅広い温度範囲において高いCapping効率を示した。
また、本酵素をmRNA Cap 2’-O-Methyltransferase(製品コード 2470A/B)(以下、2’-O-MTase)と同時に使用する場合には、Cap-0 RNAの1番目のヌクレオチドの2’-O部位がメチル化されたCap 1構造を持つRNAをシングルステップ反応で調製することも可能です*。
本酵素は、VCEと比べ、より広範囲な温度での活性を示し(30~50℃)(図1)、様々なRNAに対して頑強性を示すため、ワクチンなどのRNA医薬分野での研究開発に有用です。
「特記事項」
*Uncapped RNA(IVT合成した5’-triphosphate RNA)を元に1-stepでCap-1 RNAを調製する場合、2’-O-MTase(製品コード 2470A/B)に付属のバッファーではなく、FCE用に最適化された10×Capping Buffer 2をご使用ください。

図1.反応温度とCapping効率
本酵素(FCE)と既存酵素(VCE)を用いて、それぞれCapping反応を行い、LCMSでCapping効率(Cap 0比率)を測定した。FCEはVCEに比べ、幅広い温度範囲において高いCapping効率を示した。
用途
- Cap 0構造を持つmRNAの調製
- Cap 1構造を持つmRNAの調製(mRNA Cap 2’-O-Methyltransferaseとの併用)
内容
| Faustovirus Capping Enzyme (S17) (25 U/μl) | 500 U |
| 10×Capping Buffer 2 | 100 μl |
| S-adenosylmethionine (SAM) (32 mM) | 100 μl |
| GTP (10 mM) | 50 μl |
保存
-20℃
濃度
25 U/μl
起源
Escherichia coli carrying a plasmid containing the gene for Faustovirus capping enzyme (S17)
一般的性質
質量:約100 kDa
活性の定義
37℃において30分間に5 pmolの100 nt 転写物をCap-0 RNAに変換する酵素量を1 Uとする。
活性測定用反応液組成
| 1× | Capping Buffer 2 |
| 25 μM | GTP |
| 20 μCi/ml | [3H]SAM |
| 2.5 μg/50 μl | 100 nt RNA |
品質管理データ
性能試験結果については、各ロットのCertificate of Analysis(CoA)をご覧ください。CoAはこちらからダウンロードできます。
注意事項
- 本酵素の激しい攪拌は行わないでください。
- 基質となるRNAや試薬、反応に使用するチューブ、マイクロピペット用チップなどにRNaseが混入した場合、反応後に得られるRNAの収量が低下したり、RNAが断片化します。反応に使用するチューブ、マイクロピペット用チップは専用のものとし、反応を行うときはディスポーザブル手袋を着用して、RNaseが混入しないように注意してください。
使用例
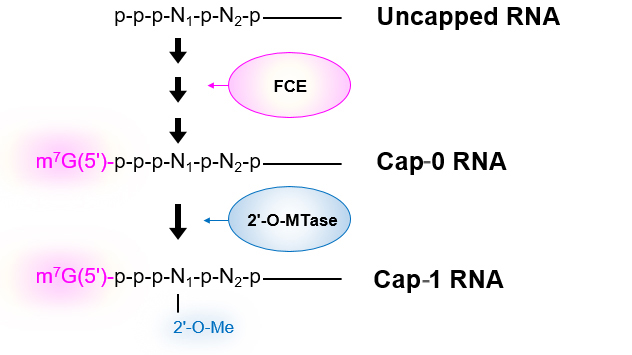
使用例-1: Uncapped RNA(5’-triphosphate RNA)からCap-0/Cap-1 RNAの調製[2-step reaction]

37℃で30分インキュベーションする。*3
続けて2’-O-MTaseを用いてCap-1 RNAの調製も可能
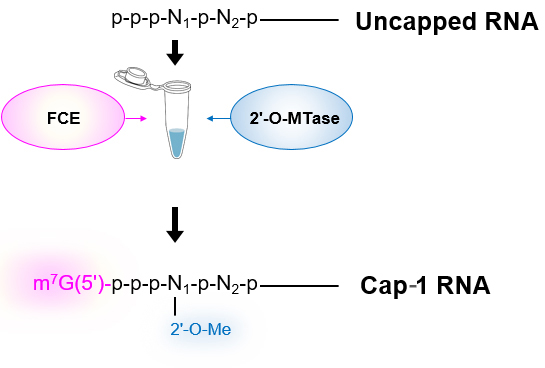
使用例-2: Uncapped RNA(5’-triphosphate RNA)からCap-1 RNAの調製[1-step reaction]

37℃で1時間インキュベーションする。*3
*1 RNA(5ʹ-triphosphate RNA)の5ʹ末端が複雑な2次構造を取る場合は、反応前に熱変性することによりキャップ付加効率が改善される可能性がある。
<熱変性>
(1)精製RNA 50 μgをRNase-free waterで38 μl(Cap-0 RNA調製)あるいは34 μl(Cap-1 RNA調製;1-step reaction)に調製する。
(2)65℃、5~10分で熱変性した後、5分氷冷する。
*2 SAMは不安定であるため、反応前に必要分を32 mMのストック溶液からRNase-free Waterで希釈調製する。希釈液は反応まで氷上で保存する。
*3 RNAのキャップ付加効率が低い場合は、酵素の使用量を増やす、または反応時間を延長する。
*4 反応ボリュームは必要に応じてスケールアップ可能。
*5 mRNA Cap 2ʹ-O-Methyltransferase(製品コード 2470A/B)に付属のバッファーではなく、Faustovirus Capping Enzyme (S17) 用に最適化された本バッファー(10×Capping Buffer 2)を使用する。
| RNA transcript (50 μg) *1 | 38 μl |
| 10×Capping Buffer 2 | 5 μl |
| GTP(10 mM) | 2.5 μl |
| SAM(2 mM, dilute 32 mM stock to 2 mM)*2 | 2.5 μl |
| Faustovirus Capping Enzyme (S17)(25 U/μl)*3 | 2 μl |
| Total | 50 μl*4 |
37℃で30分インキュベーションする。*3
続けて2’-O-MTaseを用いてCap-1 RNAの調製も可能

使用例-2: Uncapped RNA(5’-triphosphate RNA)からCap-1 RNAの調製[1-step reaction]
| RNA transcript (50 μg) *1 | 34 μl |
| 10×Capping Buffer 2*5 | 5 μl |
| GTP(10 mM) | 2.5 μl |
| SAM(4 mM, dilute 32 mM stock to 4 mM)*2 | 2.5 μl |
| Faustovirus Capping Enzyme (S17)(25 U/μl)*3 | 2 μl |
| mRNA Cap 2’-O-Methyltransferase(50 U/μl)*3 | 4 μl |
| Total | 50 μl*4 |
37℃で1時間インキュベーションする。*3

*1 RNA(5ʹ-triphosphate RNA)の5ʹ末端が複雑な2次構造を取る場合は、反応前に熱変性することによりキャップ付加効率が改善される可能性がある。
<熱変性>
(1)精製RNA 50 μgをRNase-free waterで38 μl(Cap-0 RNA調製)あるいは34 μl(Cap-1 RNA調製;1-step reaction)に調製する。
(2)65℃、5~10分で熱変性した後、5分氷冷する。
*2 SAMは不安定であるため、反応前に必要分を32 mMのストック溶液からRNase-free Waterで希釈調製する。希釈液は反応まで氷上で保存する。
*3 RNAのキャップ付加効率が低い場合は、酵素の使用量を増やす、または反応時間を延長する。
*4 反応ボリュームは必要に応じてスケールアップ可能。
*5 mRNA Cap 2ʹ-O-Methyltransferase(製品コード 2470A/B)に付属のバッファーではなく、Faustovirus Capping Enzyme (S17) 用に最適化された本バッファー(10×Capping Buffer 2)を使用する。
mRNA合成(in vitro Transcription)製品ガイド
カスタム製造・OEM
関連製品・受託
Faustovirus Capping Enzyme (S17), HQ
mRNA Cap 2'-O-Methyltransferase
RNase-free Water
Takara IVTpro™ mRNA Synthesis System
Template Vector (BspQ I) for T7 mRNA Synthesis
PrimeCap® T7 RNA Polymerase (low dsRNA)
T7 RNA Polymerase, HQ
T7 RNA Polymerase ver.2.0
Pyrophosphatase (inorganic), HQ
Pyrophosphatase (inorganic)
BspQ I, HQ
BspQ I
Recombinant RNase Inhibitor ver.2.0
この製品を見た人は、
こんな製品も見ています
-
Recombinant RNase Inhibitor ver.2.0
酸化耐性を強化したバージョンアップ品
-
mRNA Cap 2'-O-Methyltransferase
m7G capped RNA(Cap 0)をCap 1構造にするメチル基転移酵素
-

mRNA合成(in vitro Transcription)製品ガイド
-

Faustovirus Capping Enzyme (S17), HQ
幅広い温度帯で反応可能なm7G cap構造(Cap-0)付加酵素(High Quality grade)
-

PrimeCap® T7 RNA Polymerase (low dsRNA)
dsRNAの生成を大幅に低減し、高品質なmRNAの調製が可能
-

Vaccinia Capping Enzyme
RNAの5’末端にm7G cap構造(Cap 0)を付加する酵素
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。


.png)